
【题目】化学与生活息息相关。下列叙述正确的是
A. 鲜榨橙汁遇碘水会变蓝 B. 馒头越嚼越甜
C. 油脂经水解可变成葡萄糖 D. 土豆中的淀粉经水解可变成酒
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、 医药以及原子能工业中有广泛应用。以 Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的 实验装置如下图所示:

实验步骤:
步骤 1:在三颈烧瓶中加入一定量 Na2SO3 和水,搅拌溶解,
缓慢通入 SO2,至溶液 pH 约为 4,制得 NaHSO3 溶液;
步骤 2:将装置 A 中导气管换成橡皮塞。向烧瓶中加入稍过量 的锌粉和一定量甲醛溶液,在 80~90℃下,反应约 3h,冷却 至室温,抽滤;
步骤 3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置 B 的烧杯中应加入的溶液是____________;冷凝管中冷却水从____________(填“a”或“b”)口进 水。
(2)A 中多孔球泡的作用是____________。
(3)写出步骤 2 中发生反应的化学方程式____________。
(4)步骤 3 中在真空容器中蒸发浓缩的原因是是防止温度过高使产物分解,也防止____________。
(5)为了测定产品的纯度,准确称取 2.0g 样品,完全溶于水配成 100mL 溶液,取 20.00mL 所配溶 液,加入过量碘完全反应后(已知 I2 不能氧化甲醛,杂质不反应),加入 BaCl2 溶液至沉淀完全,过 滤、洗涤、干燥至恒重得到白色固体 0.466g。M(NaHSO2·HCHO·2H2O)=154g/mol]
①如何检验沉淀是否洗净____________。
②则所制得的产品的纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯硫酚(C6H5-SH)是一种用途广泛的有机合成中间体。工业上用常用氯苯(C6H5-Cl)和硫化氢(H2S)反应来制备苯硫酚,但会有副产物苯(C6H6) 生成。
I: C6H5-Cl(g)+H2S(g)![]() C6H5-SH(g)+HCl(g) △H1=-16.8 kJ/mol
C6H5-SH(g)+HCl(g) △H1=-16.8 kJ/mol
II: C6H5-Cl(g)+H2S(g)=C6H6(g)+HCl(g)+ ![]() S8(g) △H2
S8(g) △H2
反应II的焓变不易测量,现查表得如下数据:
Ⅲ: C6H5-SH(g)==C6H6(g)+ ![]() S8(g) △H3=-29.0 kJ/mol
S8(g) △H3=-29.0 kJ/mol
请回答:
(1)反应II为不可逆反应,请简述理由______________。
(2)现将一定量的氯苯和硫化氢置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20分钟测定生成物的浓度,得到图1和图2。
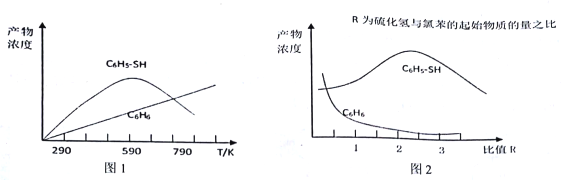
①下列说法不正确的是____________。
A.由图1可知,相同条件下反应I的活化分子百分数大于反应II 的活化分子百分数
B.图1中C6H5-SH 的浓度在590℃随温度变化的原因可能是反应II 中消耗反应物,使反应I平衡逆向移动
C.其他条件不变,由图1可知,氯苯的转化率随温度的升高而降低
D.由图2 可知,若要提高C6H5-SH 的产量,可提高硫化氢与氯苯起始物质的量之比
②590℃时,氯苯和硫化氢混合气体(体积比1:2.5,总物质的量amol)在VL的固定容积中进行反应,达到平衡时,测得容器中苯硫酚的物质的量为a/7mol,苯的物质的量为a/l4mol,则该温度下反应I的平衡常数为____。(保留两位有效数字)
③请根据图1、图2,在右图中画出恒温恒容条件下反应主产物苯硫酚的物质的量浓度随时间变化的曲线图________

(3)除了用以上方法制备苯硫酚以外,亦可电解还原苯磺酸(C6H5-SO3H,一元强酸)或苯磺酰氯来制备。以锌和石墨为电极,硫酸为电解质溶液,电解苯磺酸时的阴极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青海是我国最大的钾盐产地,某厂制得的钾盐(主要成分为KCl)混有MgCl2、CaCl2、K2SO4以及泥沙等杂质,以下是粗钾盐提纯的实验方案,各步操作流程如图,可以选用的试剂为:NaOH溶液、KOH溶液、Ba(OH)2溶液、HCl溶液、H2SO4溶液、HNO3溶液、Na2CO3溶液、K2CO3溶液

(1)过量Ca(OH)2的作用是除去溶液中的Mg2+,写出该反应的化学方程式___________。
(2)操作①和操作②都需用到玻璃棒,分别写出玻璃棒在操作①和操作②中的作用___________,_______________。
(3)试剂①、试剂②、试剂③分别为__________,____________,______________。若在操作②之前加入试剂③有什么后果___________________________________。
(4)若发现滤液浑浊,应如何操作___________________________________________。
(5)沉淀的成分有:泥沙、Mg(OH)2、BaSO4、CaCO3和_______________。
(6)除杂试剂需过量,但过量的试剂最后仍然要除去。过量的试剂③是如何除去的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液pH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是

A. a、b、c、d四个点中,水的电离程度最大的是d
B. 常温下,NH3·H2O的电离平衡常数Kb=5×10-6
C. b点溶液中:c(Na+)+c(NH4+)=c(SO42—)
D. c点溶液中:3c(Na+)= 4[c(SO42—) +c(NH4+)+ c(NH3·H2O)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
AlN 氮化铝是重要的半导体材料,Ga(镓)、P、As(砷)都是形成化合物半导体材料的重要元素。回答下列问题:
(1)As基态原子的电子占据了______个能层,最高能级的电子排布式为______。和As位于同一周期,且未成对电子数也相同的元素还有______种。
(2)元素周期表中,与P紧邻的4种元素中电负性最大的是______ (填元案符号)。Si、P、S三种元素的 第一电离能由大到小的顺序是______。
(3)NH3、PH3、AsH3三者的沸点由高到低的顺序是______。原因是______。
(4)白磷是由P4分子形成的分子晶体,P4分子呈正四面体结构,P原子位于正四面体的四个顶点,则P原子的杂化形式为_____,白磷易溶于CS2,难溶于水,原因是__________________。
(5)采用GaxIn1-xAs(镓铟砷)等材料,可提高太阳能电池的效率。GaxIn1-xAs立方体形晶胞中每个顶点和面心都有一个原子,晶胞内部有4 个原子,则该晶胞中含有_________个砷原子。
(6)AlN晶体的晶胞结构与金刚石相似(见下图),设晶胞的边长为ɑ pm,NA表示阿伏加德罗常数,则该晶体的密度为__________g·cm-3。
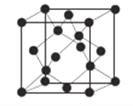
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“垃圾是放错了位置的资源”,应该分类回收.生活中废弃的铁锅、铝制的易拉罐、铜导线等可以归为一类加以回收,它们属于( )
A.氧化物
B.盐
C.金属或合金
D.碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com