
����Ŀ����֪ij��84����Һ��ƿ�岿�ֱ�ǩ��ͼ��ʾ���á�84����Һ��ͨ��ϡ��100��(���֮��)��ʹ�á���ش��������⣺

��1���á�84����Һ�������ʵ���Ũ��ԼΪ____________mol��L��1��������λ��Ч���֣���
��2��ijͬѧȡ100 mL�á�84����Һ����ϡ�ͺ�����������ϡ�ͺ����Һ��c(Na��)��________ mol��L��1��
��3����ͬѧ���ĸá�84����Һ�����䷽������NaClO��������480 mL��NaClO��������Ϊ37.25%������Һ������˵����ȷ����________(����ĸ)��

A����ͼ��ʾ�������У��������Dz���Ҫ�ģ������Ҫһ�ֲ�������
B������ƿ������ˮϴ����Ӧ��ɺ����������Һ����
C�����ƹ����У�δ������ˮϴ���ձ��Ͳ��������ܵ��½��ƫ��
D����Ҫ����NaClO���������Ϊ214.6 g
��4����84����Һ����ϡ������ʹ�ÿ���ǿ����������ij����С����Ҫ500mL 1.2mol��L��1��ϡ���ᣬ����ԭ��Ϊ98%(�ܶ�Ϊ1.84 g��cm��3)��Ũ���ᡣ
�������Ƶ�ϡ�����У�H�������ʵ���Ũ��Ϊ________ mol��L��1��
��������Ͳ��ȡŨ��������Ϊ________mL��
������ƿʹ��ǰ�����Ƿ�©ˮ��Ӧ��μ��__________________________��
�����в�����ʹ����ϡ����Ũ��ƫ�ߵ���______________��
A��ȡ��Ũ����ʱ���ӿ̶���
B������ƿ������ˮϴ�Ӻ���1.2mol/L��������ϴ
C��ת����Һʱ��������������Һ����
D������ʱ��������ƿ�̶���
E����ϡ�ͺ��ϡ��������ת������ƿ�ҽ��к����ʵ�����
F�����ݺ�����ƿ����ҡ�ȣ����ź���Һ����ڿ̶��ߣ��ֲ��伸�� ����ˮ���̶���
���𰸡�6.00.06C2.432.6������ƿ��ע������ˮ������ƿ������������ƿ�۲��Ƿ�©ˮ����������ƿ����תƿ��180�㣬��������ƿ���۲��Ƿ�©ˮABE
��������
��1������![]() ��֪�ܶ�1.2g/mL����������Ϊ37.25%�Ĵ���������Һ���ʵ���Ũ��Ϊ
��֪�ܶ�1.2g/mL����������Ϊ37.25%�Ĵ���������Һ���ʵ���Ũ��Ϊ![]() 6.0mol/L��
6.0mol/L��
��2��ϡ����100������������Һϡ���������ʵ����ʵ��������ϡ�ͺ��Ũ����0.06mol/L����������Ϊǿ����ʣ����������ʵ���Ũ�ȵ��ڴ����������ʵ���Ũ��Ϊ0.06mol/L��
��3��A������һ�����ʵ���Ũ����Һһ�㲽��Ϊ�����㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ�������Ҫ���������ձ���������ƽ����������500mL����ƿ�ͽ�ͷ�ιܣ�����ͼ��ʾ�������У��������Dz���Ҫ�ģ�ΪA��B�������Ҫ���ֲ���������Ϊ�������ͽ�ͷ�ιܣ�A����
B������ƿ������ˮϴ�����ܺ�ɣ�����ֱ��������Һ���ƣ�B����
C�����ƹ����У�δ������ˮϴ���ձ��Ͳ��������ܵ������ʵ����ʵ������٣���˽��ƫ�ͣ�C��ȷ��
D������NaClO��������480mL��NaClO��������Ϊ37.25%������Һ��Ӧѡ��500mL����ƿ��ʵ������500mL��Һ����Ҫ���ʵ�����Ϊ��0.5L��6.0mol/L��74.5g/mol=223.5g��D����
��ѡC��
��4���������Ƕ�Ԫǿ�ᣬ�������Ƶ�ϡ�����У�H�������ʵ���Ũ��Ϊ2.4 mol��L��1��
��Ũ�����Ũ����![]() ����˸���ϡ���������ʵ����ʵ��������֪������Ͳ��ȡŨ��������Ϊ
����˸���ϡ���������ʵ����ʵ��������֪������Ͳ��ȡŨ��������Ϊ![]() ��
��
������ƿʹ��ǰ�����Ƿ�©ˮ�����������Ϊ������ƿ��ע������ˮ������ƿ������������ƿ�۲��Ƿ�©ˮ����������ƿ����תƿ��180�㣬��������ƿ���۲��Ƿ�©ˮ��
��A��ȡ��Ũ����ʱ���ӿ̶��ߣ�Ũ�����������ӣ�Ũ��ƫ�ߣ�
B������ƿ������ˮϴ�Ӻ���1.2mol/L��������ϴ�����ʵ����ʵ������ӣ�Ũ��ƫ�ߣ�
C��ת����Һʱ��������������Һ���������ʵ����ʵ������٣�Ũ��ƫ�ͣ�
D������ʱ��������ƿ�̶�����Һ������ӣ�Ũ��ƫ�ͣ�
E����ϡ�ͺ��ϡ��������ת������ƿ�ҽ��к����ʵ�����������ϡ�ͷ��ȣ���ȴ����Һ������٣���Ũ��ƫ�ߣ�
F�����ݺ�����ƿ����ҡ�ȣ����ź���Һ����ڿ̶��ߣ��ֲ��伸������ˮ���̶��ߣ���Һ������ӣ�Ũ��ƫ�͡�
��ѡABE��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������У�����������( )

A. ϴ�ӳ���ʱ(��ͼ��)����©���м�����ˮ�����貢�˸�
B. ��CCl4��ȡ��ˮ�еĵ⣬ѡ��
C. ����ʱ������ƿ��Һ���������ܳ����ݻ���2/3��Һ��Ҳ��������
D. �����ᴿ��ѡ�ٺ͢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij������Ԫ��ԭ�ӵĵ������Ӳ����Ų���5�����ӣ����Ԫ�������ڱ��е�λ���ǣ� ��
A.�ڶ����ڢ�A��
B.�ڶ����ڢ�A��
C.�������ڢ�A��
D.�������ڢ�A��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������(C6H5-SH)��һ����;�㷺���л��ϳ��м��塣��ҵ���ó����ȱ�(C6H5-Cl)������(H2S)��Ӧ���Ʊ�����ӣ������и����ﱽ(C6H6) ���ɡ�
I: C6H5-Cl(g)+H2S(g)![]() C6H5-SH(g)+HCl(g) ��H1=-16.8 kJ/mol
C6H5-SH(g)+HCl(g) ��H1=-16.8 kJ/mol
II: C6H5-Cl(g)+H2S(g)=C6H6(g)+HCl(g)+ ![]() S8(g) ��H2
S8(g) ��H2
��ӦII���ʱ䲻�ײ������ֲ������������:
��: C6H5-SH(g)==C6H6(g)+ ![]() S8(g) ��H3=-29.0 kJ/mol
S8(g) ��H3=-29.0 kJ/mol
��ش�:
(1)��ӦIIΪ�����淴Ӧ�����������______________��
(2)�ֽ�һ�������ȱ�����������һ�̶��ݻ���������ģ�ҵ�������̣��ڲ�ͬ�¶��¾���Ӧ20���Ӳⶨ�������Ũ�ȣ��õ�ͼ1��ͼ2��
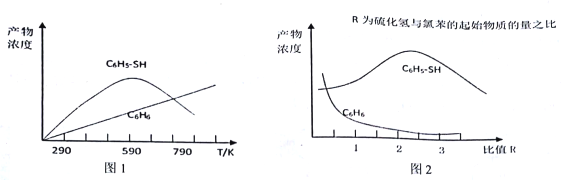
������˵������ȷ����____________��
A.��ͼ1��֪����ͬ�����·�ӦI�Ļ���Ӱٷ������ڷ�ӦII �Ļ���Ӱٷ���
B.ͼ1��C6H5-SH ��Ũ����590�����¶ȱ仯��ԭ������Ƿ�ӦII �����ķ�Ӧ�ʹ��ӦIƽ�������ƶ�
C.�����������䣬��ͼ1��֪���ȱ���ת�������¶ȵ����߶�����
D.��ͼ2 ��֪����Ҫ���C6H5-SH �IJ�����������������ȱ���ʼ���ʵ���֮��
��590��ʱ���ȱ�������������(�����1:2.5�������ʵ���amol)��VL�Ĺ̶��ݻ��н��з�Ӧ���ﵽƽ��ʱ����������б���ӵ����ʵ���Ϊa/7mol���������ʵ���Ϊa/l4mol������¶��·�ӦI��ƽ�ⳣ��Ϊ____��(������λ��Ч����)
�������ͼ1��ͼ2������ͼ�л������º��������·�Ӧ�����ﱽ��ӵ����ʵ���Ũ����ʱ��仯������ͼ________

(3)���������Ϸ����Ʊ���������⣬��ɵ�ԭ������(C6H5-SO3H��һԪǿ��)���������Ʊ�����п��ʯīΪ�缫������Ϊ�������Һ����ⱽ����ʱ��������ӦʽΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص�ص�˵������ȷ����
A.�ֻ����õ�����ӵ�����ڶ��ε��B.п�̸ɵ���У�п�缫�Ǹ���
C.�״�ȼ�ϵ�ؿɰѻ�ѧ��ת��Ϊ����D.ͭпԭ��ع���ʱ�����������·��ͭ�缫����п�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ຣ���ҹ����ļ��β��أ�ij���Ƶõļ��Σ���Ҫ�ɷ�ΪKCl������MgCl2��CaCl2��K2SO4�Լ���ɳ�����ʣ������Ǵּ����ᴿ��ʵ�鷽������������������ͼ������ѡ�õ��Լ�Ϊ��NaOH��Һ��KOH��Һ��Ba(OH)2��Һ��HCl��Һ��H2SO4��Һ��HNO3��Һ��Na2CO3��Һ��K2CO3��Һ

��1������Ca(OH)2�������dz�ȥ��Һ�е�Mg2+��д���÷�Ӧ�Ļ�ѧ����ʽ___________��
��2�������ٺͲ����ڶ����õ����������ֱ�д���������ڲ����ٺͲ������е�����___________��_______________��
��3���Լ��١��Լ��ڡ��Լ��۷ֱ�Ϊ__________��____________��______________�����ڲ�����֮ǰ�����Լ�����ʲô���___________________________________��
��4����������Һ���ǣ�Ӧ��β���___________________________________________��
��5�������ijɷ��У���ɳ��Mg(OH)2��BaSO4��CaCO3��_______________��
��6�������Լ�����������������Լ������ȻҪ��ȥ���������Լ�������γ�ȥ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���֬�������˵����ȷ����
A. ��������ˮ B. ���Ǹ߷��ӻ�����
C. ������ˮ�� D. ������C��H��O����Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
AlN ����������Ҫ�İ뵼����ϣ�Ga(��)��P��As(��)�����γɻ�����뵼����ϵ���ҪԪ�ء��ش��������⣺
(1)As��̬ԭ�ӵĵ���ռ����______���ܲ㣬����ܼ��ĵ����Ų�ʽΪ______����Asλ��ͬһ���ڣ���δ�ɶԵ�����Ҳ��ͬ��Ԫ�ػ���______�֡�
(2)Ԫ�����ڱ��У���P���ڵ�4��Ԫ���е縺��������______ (��Ԫ������)��Si��P��S����Ԫ�ص� ��һ�������ɴ�С��˳����______��
(3)NH3��PH3��AsH3���ߵķе��ɸߵ��͵�˳����______��ԭ����______��
(4)��������P4�����γɵķ��Ӿ��壬P4���ӳ���������ṹ��Pԭ��λ������������ĸ����㣬��Pԭ�ӵ��ӻ���ʽΪ_____������������CS2��������ˮ��ԭ����__________________��
(5)����GaxIn1-xAs(������)�Ȳ��ϣ������̫���ܵ�ص�Ч�ʡ�GaxIn1-xAs�������ξ�����ÿ����������Ķ���һ��ԭ�ӣ������ڲ���4 ��ԭ�ӣ���þ����к���_________����ԭ�ӡ�
(6)AlN����ľ����ṹ����ʯ����(����ͼ)���辧���ı߳�Ϊ�� pm��NA��ʾ�����ӵ���������þ�����ܶ�Ϊ__________g��cm-3��
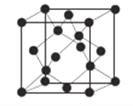
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ���˵����ȷ����
A.Ԫ�����ڱ���7�����ڣ�8������
B.Ԫ�����ڱ���18�����У���16����
C.������Ԫ���п����и���Ԫ��
D.������������ͬ��Ԫ��һ����ͬһ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com