
【题目】选择完成下列实验的装置。

(1)分离水和植物油,选用____________(填序号,下同)。
(2)用乙酸、乙醇和浓硫酸制备乙酸乙酯,选用____________。
(3)加热NH4Cl和Ca(OH)2固体混合物制取NH3,用____________ 。
【答案】② ① ③
【解析】
(1)植物油不溶于水,分离水和植物油应选用分液装置;
(2)在浓硫酸做催化剂作用下,乙酸与乙醇共热发生酯化反应生成乙酸乙酯和水,酯化反应的反应物都是液态,实验时试管口应向上倾斜;
(3)实验室用氢氧化钙固体和氯化铵固体共热反应制备氨气,制备氨气的反应物都是固体,反应时有水生成,试管口应向下倾斜。
(1)植物油不溶于水,分离水和植物油应选用分液装置,②为分液装置,故答案为:②;
(2)在浓硫酸做催化剂作用下,乙酸与乙醇共热发生酯化反应生成乙酸乙酯和水,酯化反应的反应物都是液态,实验时试管口应略向上倾斜,则①为用乙酸、乙醇和浓硫酸制备乙酸乙酯的装置,故答案为:①;
(3)实验室用氢氧化钙固体和氯化铵固体共热反应制备氨气,制备氨气的反应物都是固体,反应时有水生成,试管口应向下倾斜,则③为加热NH4Cl和Ca(OH)2固体混合物制取NH3的装置,故答案为:③。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
B. 标准状况下,2.24LSO3中所含原子数为0.4 NA
C. 常温常压下,16gO2和O3的混合气体中所含原子数目为NA
D. 在一定条件下lmolN2与3molH2反应生成的NH3分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验,请回答下列问题:
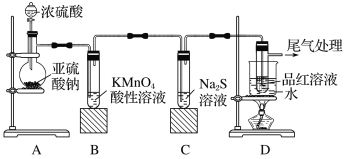
(1)装置A中盛放亚硫酸钠的仪器名称是__。
(2)实验过程中,装置B中发生的现象是__,说明SO2具有的性质是__。
(3)装置B中发生反应的离子方程式为__。
(4)尾气可采用__溶液吸收,离子方程式为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在固定容积的密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中气体的压强不再发生变化
④单位时间内生成n mol Z,同时生成n mol X
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物瑞德西韦(Remdesivir)对新冠病毒有明显抑制作用,化合物 M是合成瑞德西韦的中间体,下列关于M的说法错误的是
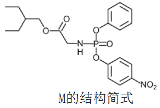
A.核磁共振氢谱共有11个吸收峰
B.分子中含有3种含氧官能团
C.分子中N原子一个是sp2杂化,一个是sp3杂化
D.1mol该物质与足量NaOH溶液反应时消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3X(g)+Y(g)![]() Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
(1)升高温度:____________; (2)增大压强:____________;
(3)增大容器容积:____________; (4)加入X:______________;
(5)加入Y:______________; (6)压缩体积:______________;
(7)加入催化剂_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
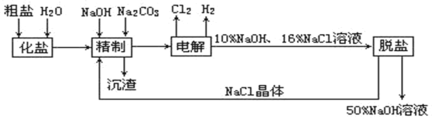
依据上图,完成下列填空:
(1)用惰性电极电解饱和食盐水时,与电源正极相连的电极上所发生的电极反应式为_____________;与电源负极相连的电极附近,溶液pH______(选填:不变、升高或下降)。
(2)如果粗盐中SO42-含量较高,必须加钡剂除去,该钡试剂可以是_________;
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为_______________、_______________;
(4)氯碱工业所用的隔膜电解装置,广泛应用于多种化工产品生产,如工业上用惰性电极电解Na2CO3溶液得到含NaHCO3,原理如下图所示。
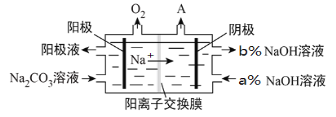
阴极产生的物质A的化学式为__________,a%_____b%(填“<、>、=”),NaHCO3产生在_______室(填“阴极”或“阳极”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,处理锌矿进行综合利用,多采用传统的“高氧酸浸法”,但该法也存在一些缺点。最近,有文献报道:用高铁闪锌矿(含有ZnS、FeS、CuS、CdS及少量SiO2等)为原料,采用“高氧催化氧化氨浸法”可以联合制取Cu2O(红色)、CdS(黄色)、锌钡白(白色)三种颜料,其流程如图:
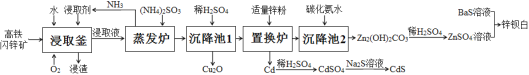
已知:
Ⅰ:浸取剂由碳酸铵、氨水、双氧水等组成;
Ⅱ:浸渣为S、Fe(OH)CO3、SiO2等不溶性物质;
Ⅲ:浸取液中含有[Zn(NH3)4]2+、[Cu(NH3)4]2+、[Cd(NH3)4]2+;
Ⅳ:Cu+在溶液中不存在,但可以与NH3形成稳定的[Cu(NH3)2]+。
回答下列问题:
(1)为加快浸取速度,可以采取的措施是(任答两项)_______;在实际生产中采取常温下浸取而不采用加热的方法,其原因是___。
(2)浸取釜中有O2参与生成浸渣Fe(OH)CO3的离子方程式为_______。
(3)蒸发炉中加入(NH4)2SO3的主要作用是_________;沉降池1中加入稀H2SO4的作用是_______。
(4)在制取ZnSO4和CdSO4时使用硫酸的量要适当,如果硫酸过量,产生的后果是______。
(5)无论采用“高氧酸浸法”还是“高氧催化氧化氨浸法”,其前期处理,都要经过用浸取剂浸取这一步,不同的是“高氧酸浸法”需先高温焙烧,然后再用硫酸浸出。两种方法比较,“高氧酸浸法”存在的缺点是(任答两条)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的![]() 元素,用元素符号或化学式填空回答以下问题:
元素,用元素符号或化学式填空回答以下问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 |
|
| ||||||
三 |
|
|
|
|
|
| ||
四 |
|
|
(1)化学性质最不活泼的元素原子的原子结构示意图为________;
(2)元素![]() 、
、![]() 的简单氢化物中的稳定性最强的是______________
的简单氢化物中的稳定性最强的是______________![]() 用化学式表示
用化学式表示![]() ;
;
(3)元素的最高价氧化物对应的水化物中酸性最强的是________,碱性最强的是_______,呈两性的氢氧化物是_______________,元素![]() 的最高价氧化物对应水化物中含有的化学键类型为________________;
的最高价氧化物对应水化物中含有的化学键类型为________________;
(4)在![]() 四种元素中,简单离子半径最小的是_________;
四种元素中,简单离子半径最小的是_________;
(5)![]() 的电子式为___________;
的电子式为___________;![]() 的电子式为_________;
的电子式为_________;
(6)在![]() 与
与![]() 的单质中,氧化性较强的是__________,用化学反应方程式证明:___________________________。
的单质中,氧化性较强的是__________,用化学反应方程式证明:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com