
| 放电 |
| 充电 |
| A、放电过程中,Li向负极区移动 |
| B、正极的电极反应式:LixC6+xe-=xLi+Li1-xC6 |
| C、电子流动方向:负极→外电路→正极→有机电解液→负极 |
| D、充电时阳极电极反应式:LiCoO2-xe-=Li1-xCoO2+x Li |


 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:
| A、①②④ | B、①③⑤ |
| C、②⑥ | D、②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“四中子”不显电性 |
| B、第二种粒子是氧元素的另一种同位素 |
| C、“四中子”的质量与一个4He原子质量近似相等 |
| D、第二种粒子的化学式为O4,与O2互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知25℃时NH4CN显碱性,则25℃时的电离常数K(NH3?H2O)>K(HCN) |
| B、25℃时,Mg(OH)2固体在20 mL0.01 mol?L-1氨水中的Ksp比在20 mL0.01 mol?L-1 NH4Cl溶液中的Ksp小 |
| C、pH试纸测得新制氯水的pH为4 |
| D、FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 反应物质 | 反应结果 | 影响因素 |
| A | Na O2 | Na2O Na2O2 | 反应温度 |
| B | Cu HNO3 | NO NO2 | 铜的还原性 |
| C | Na2S溶液 SO2 | 澄清或者浑浊 | SO2通入量 |
| D | AgNO3 NH3.H2O | 澄清或者浑浊 | 试剂加入顺序 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 用电化学原理研究金属铝具有重要的意义.
用电化学原理研究金属铝具有重要的意义.| 3 |
| 2 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
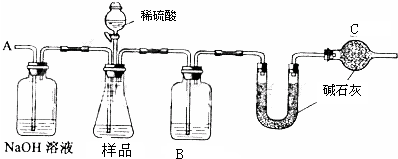
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com