
| A、已知25℃时NH4CN显碱性,则25℃时的电离常数K(NH3?H2O)>K(HCN) |
| B、25℃时,Mg(OH)2固体在20 mL0.01 mol?L-1氨水中的Ksp比在20 mL0.01 mol?L-1 NH4Cl溶液中的Ksp小 |
| C、pH试纸测得新制氯水的pH为4 |
| D、FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案科目:高中化学 来源: 题型:
| 元素 性质 | 9F | 17Cl | 35Br | 53I | ||
| 单质熔点(℃) | -219.6 | -101 | 113.5 | |||
| 单质沸点(℃) | -188.1 | -34.6 | 58.78 | 184.4 | ||
| 主要化合价 | -1 | -1,+1, +3,+5, +7 | -1,+1, +3,+5, +7 | |||
| 原子半径 |
| |||||
| 单质与H2反应情况 | 暗处剧烈化合并爆炸 | 光照或点燃反应 | 加热至一定温度反应 | 不断加热才缓慢反应 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2L溶液中的阴、阳离子总数为0.8NA |
| B、500mL溶液中NO3-离子浓度为0.2mol?L-1 |
| C、500mL溶液中Ba2+离子浓度为0.2mol?L-1 |
| D、500mL溶液中NO3-离子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 反应1 |
| 反应2 |
| C2H5OHNaOH |
| 反应3 |
 )
)查看答案和解析>>
科目:高中化学 来源: 题型:
 RCOOH+CO2↑②
RCOOH+CO2↑②

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCN溶液和NaOH溶液不等体积混合后一定存在c(H+)-c(OH-)=c(CN-)-c(Na+) |
| B、等温下,等浓度的CH3COONa溶液和NaCN溶液的pH,后者大 |
| C、常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH的变化小 |
| D、溶液中由水电离出的c(H+),前者是后者的10m-n倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电过程中,Li向负极区移动 |
| B、正极的电极反应式:LixC6+xe-=xLi+Li1-xC6 |
| C、电子流动方向:负极→外电路→正极→有机电解液→负极 |
| D、充电时阳极电极反应式:LiCoO2-xe-=Li1-xCoO2+x Li |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、①③④⑤ |
| C、①③⑤ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
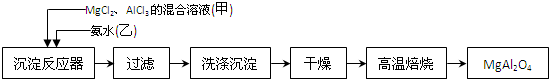
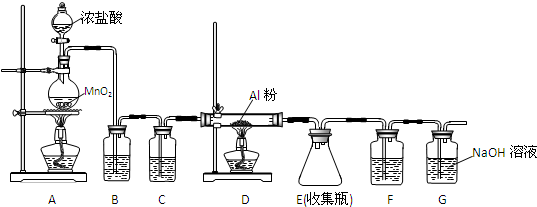
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com