
 RCOOH+CO2↑②
RCOOH+CO2↑②

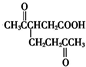 ,根据信息中的反应原理可知,二氧化碳中的碳原来在柠檬烯中是CH2=结构,
,根据信息中的反应原理可知,二氧化碳中的碳原来在柠檬烯中是CH2=结构, 中的羰基和羧基中的碳原来在柠檬烯中都是碳碳双键中的碳,柠檬烯中含有一个六元环,据此可推断柠檬烯的结构为
中的羰基和羧基中的碳原来在柠檬烯中都是碳碳双键中的碳,柠檬烯中含有一个六元环,据此可推断柠檬烯的结构为 ,
, 与足量的氢气反应生成A为
与足量的氢气反应生成A为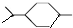 ,
, 与足量的溴反应生成B为
与足量的溴反应生成B为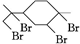 ,据此答题.
,据此答题. ,根据信息中的反应原理可知,二氧化碳中的碳原来在柠檬烯中是CH2=结构,
,根据信息中的反应原理可知,二氧化碳中的碳原来在柠檬烯中是CH2=结构, 中的羰基和羧基中的碳原来在柠檬烯中都是碳碳双键中的碳,柠檬烯中含有一个六元环,据此可推断柠檬烯的结构为
中的羰基和羧基中的碳原来在柠檬烯中都是碳碳双键中的碳,柠檬烯中含有一个六元环,据此可推断柠檬烯的结构为 ,
, 与足量的氢气反应生成A为
与足量的氢气反应生成A为 ,
, 与足量的溴反应生成B为
与足量的溴反应生成B为 ,
, ,故答案为:
,故答案为: ;
;  ,A的核磁共振氢谱有7个峰,故答案为:7;
,A的核磁共振氢谱有7个峰,故答案为:7; +2Br2→
+2Br2→ ,故答案为:
,故答案为: +2Br2→
+2Br2→ ;
;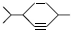 ,故答案为:
,故答案为: .
.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
| A、LiOH、NaOH、KOH、CsOH |
| B、CsOH、KOH、NaOH、LiOH |
| C、KOH、CsOH、LiOH、NaOH |
| D、KOH、NaOH、CsOH、LiOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“四中子”不显电性 |
| B、第二种粒子是氧元素的另一种同位素 |
| C、“四中子”的质量与一个4He原子质量近似相等 |
| D、第二种粒子的化学式为O4,与O2互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知25℃时NH4CN显碱性,则25℃时的电离常数K(NH3?H2O)>K(HCN) |
| B、25℃时,Mg(OH)2固体在20 mL0.01 mol?L-1氨水中的Ksp比在20 mL0.01 mol?L-1 NH4Cl溶液中的Ksp小 |
| C、pH试纸测得新制氯水的pH为4 |
| D、FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 反应物质 | 反应结果 | 影响因素 |
| A | Na O2 | Na2O Na2O2 | 反应温度 |
| B | Cu HNO3 | NO NO2 | 铜的还原性 |
| C | Na2S溶液 SO2 | 澄清或者浑浊 | SO2通入量 |
| D | AgNO3 NH3.H2O | 澄清或者浑浊 | 试剂加入顺序 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用电化学原理研究金属铝具有重要的意义.
用电化学原理研究金属铝具有重要的意义.| 3 |
| 2 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 |
| 乙二醇(C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com