
| A、LiOH、NaOH、KOH、CsOH |
| B、CsOH、KOH、NaOH、LiOH |
| C、KOH、CsOH、LiOH、NaOH |
| D、KOH、NaOH、CsOH、LiOH |
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
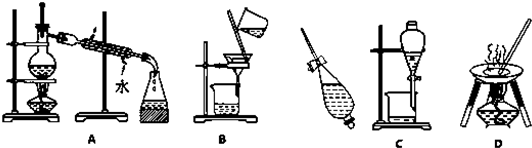
查看答案和解析>>
科目:高中化学 来源: 题型:
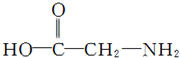 )是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是
)是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是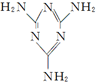 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(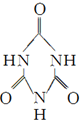 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数:Y>X>Z>W |
| B、离子半径:X>Y>Z>W |
| C、原子最外层电子数:Z>W>Y>X |
| D、还原性:X>Y,W2->Z- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 性质 | 9F | 17Cl | 35Br | 53I | ||
| 单质熔点(℃) | -219.6 | -101 | 113.5 | |||
| 单质沸点(℃) | -188.1 | -34.6 | 58.78 | 184.4 | ||
| 主要化合价 | -1 | -1,+1, +3,+5, +7 | -1,+1, +3,+5, +7 | |||
| 原子半径 |
| |||||
| 单质与H2反应情况 | 暗处剧烈化合并爆炸 | 光照或点燃反应 | 加热至一定温度反应 | 不断加热才缓慢反应 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同周期元素的原子半径以ⅦA族的为最大 |
| B、在周期表中零族元素的单质不全部是气体 |
| C、ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子 |
| D、所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 RCOOH+CO2↑②
RCOOH+CO2↑②

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com