
对于反应CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
我们知道海带中含有碘元素,经常食用海带可以防治甲状腺肿大,所以工业上常用海带为原料提取碘单质。查有关资料可知碘单质有升华现象。下面是某校化学探究小组设计的从海带中提取单质碘的实验,请你完成下列实验。
(1)将干燥洁净的海带用酒精湿润后在__________(填一种仪器名称)中灼烧成灰烬。
(2)将海带灰烬冷却至室温,转移到烧杯中,加蒸馏水后,搅拌、煮沸、冷却、__________(填一种操作名称)。
(3)在滤液中滴入几滴稀硫酸,再加入一定量的过氧化氢溶液,此时发生反应的离子方程式为:__________________________________。
(4)把(3)中所得到的溶液注入分液漏斗中,然后再加入四氯化碳,振荡、静置,可以观察到四氯化碳层呈________色。经分液得到碘的四氯化碳溶液,在这一实验过程中,四氯化碳起____________作用。
(5)用试管取碘的四氯化碳溶液用水浴加热,待四氯化碳挥发完即可得到固体碘单质。为什么不用酒精灯直接加热蒸发四氯化碳:_____________________________。
(6)证明得到的固体是碘单质的化学方法是_____________________________________
__________________________________ ______________________________________。
______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G均为有机化合物。
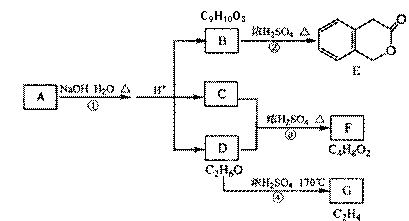 |
根据上图回答问题:
(1)A的分子式是 ,B 的结构简式是
(2)反应③的化学方程式是 。
(3)写出反应①至④中属于消去反应的化学方程式 。
(4)符合下列3个条件的B的同分异构体的所有的结构简式
(i). 可发生银镜反应
(ii) 核磁共振氢谱有5种峰
(iii)与FeCl3溶液发生显色反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子
B.1 mol Al分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移的电子均为3NA
C.各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
D.24 g镁与足量的盐酸或NaOH溶液反应转移的电子数目均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
联合国气候变化大会2009年12月7日在丹麦首都哥本哈根拉开帷幕,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
工业上有一种方法是用CO2来生产燃料甲醇,298.15K时,CO2、H2、与CH3OH、H2O的平均能量与合成甲醇反应的活化能的曲线图如图1所示,据图回答问题:


图1 图2
(1)写出合成甲醇反应的热化学方程式 ;
(2)在图中曲线 (填“a”或“b”)表示加入催化剂的能量变化曲线。
(3)在体积为l L的密闭容器中,充入lmolCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数为__________________,升高温度,K值 (填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O,则阴极反应式为:_______________________________ 。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:__________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g
2NH3(g ) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为φ,下列说法中正确的是
) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为φ,下列说法中正确的是

A.若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图甲所示
B.反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
C.如图丙所示,容器Ⅰ和Ⅱ达到平衡时所需要的时间可能不同
D.若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
查看答案和解析>>
科目:高中化学 来源: 题型:
反应N2O4(g)2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是

A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a深,c浅
C.由状态b到状态a,可以用加热的方法
D.a、c两点气体的平均相对分子质量:a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
为了预防碘缺乏病,有关部门规定食盐中的碘含量(以I计)应在20~50 mg/kg。制备KIO3的方法如下:
方法1:6I2+11KClO3+3H2O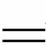 6KH(IO3)2+5KCl+3Cl2↑
6KH(IO3)2+5KCl+3Cl2↑
KH(IO3)2+KOH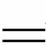 2KIO3+H2O
2KIO3+H2O
方法2:碱性条件下,KI+3H2O KIO3+3H2↑
KIO3+3H2↑
方法3:I2 HIO3
HIO3 KIO3
KIO3
(1)与方法3相比方法1的不足是________________________________________________________________________,
方法2的不足是________________________________________________________________________。
(2)方法2选用的电极是惰性电极,则其阳极反应式是________________________________________________________________________。
(3)方法3反应温度控制在70 ℃左右,不采用更高温度的主要原因是________________________________________________________________________。
(4)制备纯净KIO3的实验步骤中,最后需将所得晶体最好使用____________________洗涤2~3次,干燥后得产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
N和B元素在化学中有很重要的地位。
(1)写出与N元素同主族的As元素的基态原子核外电子排布式_________________。
从原子结构的角度分析B、N和O元素的第一电离能由大到小的顺序为___________。
(2)N元素与B元素的氟化物化学式相似,均为AB3型,但分子的空间结构有很大不同,其中NF3的分子空间构型为 ,BF3的分子空间构型为 。
(3)NaN3是抗禽流感药物“达菲”合成过程中的中间活性物质,NaN 3也可用于汽
车的保护气囊。3 mol NaN 3受撞击会生成4 mol N2气体和一种离子化合物A。
①请写出上述NaN 3撞击反应的化学方程式 。
②根据电子云的重叠方式判断:N2分子与NH3分子中σ键数目之比为 : 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com