
反应N2O4(g)2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是

A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a深,c浅
C.由状态b到状态a,可以用加热的方法
D.a、c两点气体的平均相对分子质量:a>c
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等.下列反应与反应Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
A.2Na2O2+2H2O =4NaOH+O2↑ B.Cl2 + H2O  HClO + HCl
HClO + HCl
C.2F2+2H2O=4HF+O2 D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:

若按实验原则进行操作,则两者制得单质铜的量的比较正确的是( )
A.①多 B.②多 C.相等 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
对可逆反应2A(s)+3B(g)  C(g)+2D(g) ΔH<0,在一定条件下达到平衡。下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡。下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动 ②升高温度,平衡向逆反应方向移动,v(正)减小 ③压强增大一倍,平衡不移动,v(正)、v(逆)不变 ④增大B的浓度, v(正)>v(逆) ⑤加入催化剂,B的转化率提高
v(正)>v(逆) ⑤加入催化剂,B的转化率提高
A.①② B.④
C.③ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)一定条件下,发生反应CO(g)+H2O(g)  CO2(g)+H2(g),向2 L密闭容器中通入2 mol CO(g)、1 mol H2O(g),2 min 后反应达到平衡时,测得CO的物质的量为1.6 mol,用H2O(g)表示该反应速率为____________,此温度下,该反应的平衡常数为________。若往容器中再加入2 mol CO(g),则重新达到平衡时的CO总转化率________20%(填“>”、“<”或“=”)。
CO2(g)+H2(g),向2 L密闭容器中通入2 mol CO(g)、1 mol H2O(g),2 min 后反应达到平衡时,测得CO的物质的量为1.6 mol,用H2O(g)表示该反应速率为____________,此温度下,该反应的平衡常数为________。若往容器中再加入2 mol CO(g),则重新达到平衡时的CO总转化率________20%(填“>”、“<”或“=”)。
(2)在一密闭容器中发生反应2NO2 2NO+O2 ΔH>0,反应过程中NO2的浓度随时间变化的情况如下图所示:
2NO+O2 ΔH>0,反应过程中NO2的浓度随时间变化的情况如下图所示:
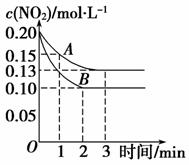
若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则曲线B此条件可能是________(填“增大压强”、“减小压强”、“升高温度”、“降低温度”或“使 用催化剂”)。
用催化剂”)。
(3)一定温度下,在密闭容器中N2O5可发生下列反应:
①2N2O5(g)  4NO2(g)+O2(g)
4NO2(g)+O2(g)
②2NO2(g)  2NO(g)+O2(g)
2NO(g)+O2(g)
若达平衡时,c(NO2)=0.6 mol·L-1,c(O2)=1.3 mol·L-1,则反应②中NO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在“绿色化学”工艺中,理想状态是反应物中的原子全部转化为目标产物,即原子利用率为100%。在下列反应类型中:①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥消去反应 ⑦加聚反应 ⑧缩聚反应
能体现这一原子经济性原则的是( )
A.①②⑤ B.②⑤⑦
C.⑥⑦⑧ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
有两种短周期元素X和Y,可组成化合物XY3,当Y的原子序数为m时,X的原子序数为:①m-4;②m+4;③m+8;④m-2;⑤m+6。其中正确的组合是( )
A.①②④ B.①②⑤ C.①②③⑤ D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com