
在“绿色化学”工艺中,理想状态是反应物中的原子全部转化为目标产物,即原子利用率为100%。在下列反应类型中:①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥消去反应 ⑦加聚反应 ⑧缩聚反应
能体现这一原子经济性原则的是( )
A.①②⑤ B.②⑤⑦
C.⑥⑦⑧ D.③④⑤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、B、C、D、E、F、G均为有机化合物。
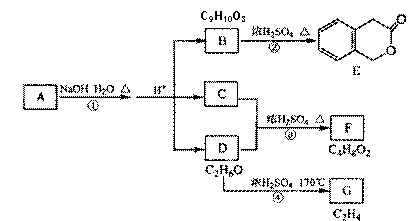 |
根据上图回答问题:
(1)A的分子式是 ,B 的结构简式是
(2)反应③的化学方程式是 。
(3)写出反应①至④中属于消去反应的化学方程式 。
(4)符合下列3个条件的B的同分异构体的所有的结构简式
(i). 可发生银镜反应
(ii) 核磁共振氢谱有5种峰
(iii)与FeCl3溶液发生显色反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应N2O4(g)2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是

A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a深,c浅
C.由状态b到状态a,可以用加热的方法
D.a、c两点气体的平均相对分子质量:a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
为了预防碘缺乏病,有关部门规定食盐中的碘含量(以I计)应在20~50 mg/kg。制备KIO3的方法如下:
方法1:6I2+11KClO3+3H2O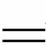 6KH(IO3)2+5KCl+3Cl2↑
6KH(IO3)2+5KCl+3Cl2↑
KH(IO3)2+KOH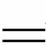 2KIO3+H2O
2KIO3+H2O
方法2:碱性条件下,KI+3H2O KIO3+3H2↑
KIO3+3H2↑
方法3:I2 HIO3
HIO3 KIO3
KIO3
(1)与方法3相比方法1的不足是________________________________________________________________________,
方法2的不足是________________________________________________________________________。
(2)方法2选用的电极是惰性电极,则其阳极反应式是________________________________________________________________________。
(3)方法3反应温度控制在70 ℃左右,不采用更高温度的主要原因是________________________________________________________________________。
(4)制备纯净KIO3的实验步骤中,最后需将所得晶体最好使用____________________洗涤2~3次,干燥后得产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下反应最符合绿色化学原子经济性要求的是( )
A.乙烯聚合为聚乙烯高分子材料
B.甲烷与氯气制备一氯甲烷
C.以铜和浓硝酸为原料生产硝酸铜
D.用SiO2制备高纯硅
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.石油中含有C5~C 11的烷烃,可以通过石油的分馏得到汽油
11的烷烃,可以通过石油的分馏得到汽油
B.含C18以上烷烃的重油经过催化裂解可以得到汽油
C.煤是由有机物和无机物组成的复杂的混合物
D.煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p3; ④1s22s22p5。则下列有关比较中正确的是
A.第一电离能:①>② B.原子半径:④>③
C.电负性: ②>③ D.氢化物稳定性:①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
N和B元素在化学中有很重要的地位。
(1)写出与N元素同主族的As元素的基态原子核外电子排布式_________________。
从原子结构的角度分析B、N和O元素的第一电离能由大到小的顺序为___________。
(2)N元素与B元素的氟化物化学式相似,均为AB3型,但分子的空间结构有很大不同,其中NF3的分子空间构型为 ,BF3的分子空间构型为 。
(3)NaN3是抗禽流感药物“达菲”合成过程中的中间活性物质,NaN 3也可用于汽
车的保护气囊。3 mol NaN 3受撞击会生成4 mol N2气体和一种离子化合物A。
①请写出上述NaN 3撞击反应的化学方程式 。
②根据电子云的重叠方式判断:N2分子与NH3分子中σ键数目之比为 : 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,对于反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是

A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量 为92.4 kJ
为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增 大压强,H2的转化率增大
大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com