
为了预防碘缺乏病,有关部门规定食盐中的碘含量(以I计)应在20~50 mg/kg。制备KIO3的方法如下:
方法1:6I2+11KClO3+3H2O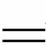 6KH(IO3)2+5KCl+3Cl2↑
6KH(IO3)2+5KCl+3Cl2↑
KH(IO3)2+KOH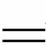 2KIO3+H2O
2KIO3+H2O
方法2:碱性条件下,KI+3H2O KIO3+3H2↑
KIO3+3H2↑
方法3:I2 HIO3
HIO3 KIO3
KIO3
(1)与方法3相比方法1的不足是________________________________________________________________________,
方法2的不足是________________________________________________________________________。
(2)方法2选用的电极是惰性电极,则其阳极反应式是________________________________________________________________________。
(3)方法3反应温度控制在70 ℃左右,不采用更高温度的主要原因是________________________________________________________________________。
(4)制备纯净KIO3的实验步骤中,最后需将所得晶体最好使用____________________洗涤2~3次,干燥后得产品。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
25℃和101kPa时,乙烯、乙炔和丙炔组成的混合烃20mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了35mL,原混合烃中乙炔的体积分数为 ( )
A. 75% B. 12.5% C. 25% D. 50%
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)一定条件下,发生反应CO(g)+H2O(g)  CO2(g)+H2(g),向2 L密闭容器中通入2 mol CO(g)、1 mol H2O(g),2 min 后反应达到平衡时,测得CO的物质的量为1.6 mol,用H2O(g)表示该反应速率为____________,此温度下,该反应的平衡常数为________。若往容器中再加入2 mol CO(g),则重新达到平衡时的CO总转化率________20%(填“>”、“<”或“=”)。
CO2(g)+H2(g),向2 L密闭容器中通入2 mol CO(g)、1 mol H2O(g),2 min 后反应达到平衡时,测得CO的物质的量为1.6 mol,用H2O(g)表示该反应速率为____________,此温度下,该反应的平衡常数为________。若往容器中再加入2 mol CO(g),则重新达到平衡时的CO总转化率________20%(填“>”、“<”或“=”)。
(2)在一密闭容器中发生反应2NO2 2NO+O2 ΔH>0,反应过程中NO2的浓度随时间变化的情况如下图所示:
2NO+O2 ΔH>0,反应过程中NO2的浓度随时间变化的情况如下图所示:
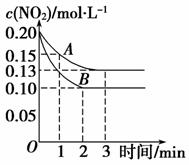
若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则曲线B此条件可能是________(填“增大压强”、“减小压强”、“升高温度”、“降低温度”或“使 用催化剂”)。
用催化剂”)。
(3)一定温度下,在密闭容器中N2O5可发生下列反应:
①2N2O5(g)  4NO2(g)+O2(g)
4NO2(g)+O2(g)
②2NO2(g)  2NO(g)+O2(g)
2NO(g)+O2(g)
若达平衡时,c(NO2)=0.6 mol·L-1,c(O2)=1.3 mol·L-1,则反应②中NO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
煤是一种重要的能源,含有硫元素,燃烧时会生成SO2。 下列说法正确的是( )
A.煤是含硫化合物
B.煤是一种可再生能源
C.在水吸收SO2的过程中只发生物理变化
D.SO2是酸性氧化物,被云雾吸收后可转化成酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
在“绿色化学”工艺中,理想状态是反应物中的原子全部转化为目标产物,即原子利用率为100%。在下列反应类型中:①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥消去反应 ⑦加聚反应 ⑧缩聚反应
能体现这一原子经济性原则的是( )
A.①②⑤ B.②⑤⑦
C.⑥⑦⑧ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
溴苯是一种常用的化工原料。实验室制备溴苯
的实验步骤如下:
步骤1:在a中加入15 mL苯和少量铁屑,再将b中4.0 mL
液溴慢慢加入到a中,充分反应。
步骤2:向a中加入10 mL水,然后过滤除去未反应的铁屑。
步骤3:滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL 水洗涤,分液得粗溴苯。
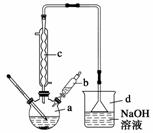 步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品。
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品。
| 苯 | 溴 | 溴苯 | |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(1)仪器d的作用是 。
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是 。
(3)仪器c的作用是冷凝回流,回流的主要物质有 (填化学式)。
(4)步骤4得到的粗产品中还含有杂质苯。已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com