
����Ŀ����������Ҫ����ұ�����ָ֣� ����Ϊ ���Ͻ��ά����������ҵ�ϳ��ø���¯�� ����Ҫ��FeO��V2O3�� ��������P2O5�����ʣ� ��ȡ������������ͼ��
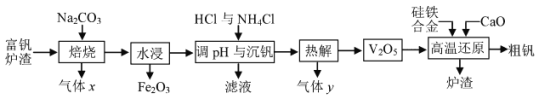
�ش��������⣺
(1)��֪�������ȷ���4FeO��V2O3+5O2![]() 4V2O5+2Fe2O3��Ӧ�� ������������__����һ�����ɿ�����NaVO3�ķ�Ӧ����ʽΪ______��
4V2O5+2Fe2O3��Ӧ�� ������������__����һ�����ɿ�����NaVO3�ķ�Ӧ����ʽΪ______��
(2)25��ʱ��Ksp(NH4VO3)��4��10-2������ƽ�ⳣ��Kb(NH3��H2O) ��1.8��10-5���������� ��VO3-��Ũ��Ϊ![]() mol/L������Һ��pHΪ___����OH-��VO3-�⣬��Һ�л����ܴ��ڵ���������__��
mol/L������Һ��pHΪ___����OH-��VO3-�⣬��Һ�л����ܴ��ڵ���������__��
(3) ���Ƚ��� ���̲��������� y�ĵ���ʽΪ__��
(4)�������»�ԭ��Ӧ�ķ���ʽΪ_____��¯������Ҫ�ɷ���__��
(5)�������Ľ�����ǿ����ҵ��ͨ����⾫�� ���ַ��� �ɵõ�99.5%�Ĵ����� ������LiCl��KCl��VCl2Ϊ����ʣ����ַ��� �к��������衣�� ���ַ��� Ӧ���ӵ�Դ��___���� �����ĵ缫��ӦʽΪ__��
���𰸡�V2O5��Fe2O3 V2O5��Na2CO3![]() 2NaVO3��CO2�� 4.5 Cl-��H2PO42-��PO43-��HPO42-
2NaVO3��CO2�� 4.5 Cl-��H2PO42-��PO43-��HPO42- ![]() 5Si��2V2O5
5Si��2V2O5![]() 4V��5SiO2��5Si��2V2O5��5CaO
4V��5SiO2��5Si��2V2O5��5CaO![]() 4V��5CaSiO3 CaSiO3 ���� V2+��2e-��V
4V��5CaSiO3 CaSiO3 ���� V2+��2e-��V
��������
�����ǽ�FeO��V2O3ת��Ϊ������NaVO3���������Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ��4FeO��V2O3+4Na2CO3+5O2 ![]() 8NaVO3+2Fe2O3+4CO2������xΪCO2��ˮ����������Ϊ���������õ�NaVO3��Һ����Һ�м���NH4Cl��������NH4VO3�����ȷֽ�����V2O5���Ͱ���������ù�����ԭ���������»�ԭ��Ӧ�ķ���ʽΪ5Si��2V2O5
8NaVO3+2Fe2O3+4CO2������xΪCO2��ˮ����������Ϊ���������õ�NaVO3��Һ����Һ�м���NH4Cl��������NH4VO3�����ȷֽ�����V2O5���Ͱ���������ù�����ԭ���������»�ԭ��Ӧ�ķ���ʽΪ5Si��2V2O5![]() 4V��5SiO2��5Si��2V2O5��5CaO
4V��5SiO2��5Si��2V2O5��5CaO![]() 4V��5CaSiO3 ��¯������Ҫ�ɷ���CaSiO3��
4V��5CaSiO3 ��¯������Ҫ�ɷ���CaSiO3��
��1���������ȷ���4FeO��V2O3+5O2![]() 4V2O5+2Fe2O3��Ӧ������+2������Ϊ+3�ۣ�����+3������Ϊ+5�ۣ������������� V2O5��Fe2O3����һ�����ɿ�����NaVO3�ķ�Ӧ����ʽΪV2O5��Na2CO3
4V2O5+2Fe2O3��Ӧ������+2������Ϊ+3�ۣ�����+3������Ϊ+5�ۣ������������� V2O5��Fe2O3����һ�����ɿ�����NaVO3�ķ�Ӧ����ʽΪV2O5��Na2CO3![]() 2NaVO3��CO2�� ���ʴ�Ϊ�� V2O5��Fe2O3��V2O5��Na2CO3
2NaVO3��CO2�� ���ʴ�Ϊ�� V2O5��Fe2O3��V2O5��Na2CO3![]() 2NaVO3��CO2�� ��
2NaVO3��CO2�� ��
��2��25��ʱ��Ksp(NH4VO3)��4��10-2������ƽ�ⳣ��Kb(NH3��H2O) ��1.8��10-5���������� ��VO3-��Ũ��Ϊ![]() mol��L��1��Ksp(NH4VO3)��4��10-2=c(NH4+)c(VO3-)��c(NH4+)=
mol��L��1��Ksp(NH4VO3)��4��10-2=c(NH4+)c(VO3-)��c(NH4+)=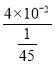 =1.8 mol��L��1,
=1.8 mol��L��1,

Kh=![]() ,x=c(H+)=10-4.5mol��L��1,����Һ��pHΪ4.5����OH-��VO3-�⣬P2O5����ˮ������������H2PO42-��PO43-��HPO42- ����Һ�л����ܴ��ڵ���������Cl-��H2PO42-��PO43-��HPO42- ���ʴ�Ϊ��4.5��Cl-��H2PO42-��PO43-��HPO42- ��
,x=c(H+)=10-4.5mol��L��1,����Һ��pHΪ4.5����OH-��VO3-�⣬P2O5����ˮ������������H2PO42-��PO43-��HPO42- ����Һ�л����ܴ��ڵ���������Cl-��H2PO42-��PO43-��HPO42- ���ʴ�Ϊ��4.5��Cl-��H2PO42-��PO43-��HPO42- ��
��3�����Ƚ��� ���̲��������� y�ǰ�����Nԭ���������5�����ӣ���3����ԭ���γ�3�����õ��Ӷԣ�����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��4�������ʱ������ԭ��ͬʱ���ɵĶ����������������γ�¯�����������»�ԭ��Ӧ�ķ���ʽΪ5Si��2V2O5![]() 4V��5SiO2��5Si��2V2O5��5CaO
4V��5SiO2��5Si��2V2O5��5CaO![]() 4V��5CaSiO3 ��¯������Ҫ�ɷ���CaSiO3���ʴ�Ϊ��5Si��2V2O5
4V��5CaSiO3 ��¯������Ҫ�ɷ���CaSiO3���ʴ�Ϊ��5Si��2V2O5![]() 4V��5SiO2��5Si��2V2O5��5CaO
4V��5SiO2��5Si��2V2O5��5CaO![]() 4V��5CaSiO3 ��CaSiO3��
4V��5CaSiO3 ��CaSiO3��
��5��������LiCl��KCl��VCl2Ϊ����ʣ����ַ��� �к��������裬 ���ַ��� Ӧ���ӵ�Դ������������������Ӧ�������õ��ӷ�����ԭ��Ӧ�������ĵ缫��ӦʽΪV2+��2e-��V���ʴ�Ϊ������V2+��2e-��V��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���(S2Cl2)��һ�ֻƺ�ɫҺ�壬�д̼��ԡ���Ϣ�Զ�����ڿ�����ǿ�ҷ��̣�����ˮ����ˮ�ⷴӦ���۵�Ϊ-80�棬�е�137.l�档�����ڵ�����ͨ��������������S2Cl2����ͼ��ʵ������S��Cl2�Ʊ�S2Cl2��װ�ã����ּг�װ������ȥ����
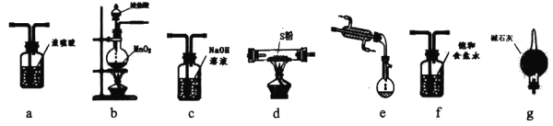
��ش�
��1���������ṩ��ͼƬ��ѡ����Ҫ��װ�ò��������Ʊ�S2Cl2��b��___��
��2����֪S2Cl2ˮ��ʱ��ֻ��һ��Ԫ�صĻ��ϼ۷����˱仯���ұ������ͱ���ԭ�ĸ�Ԫ�ص����ʵ���֮��Ϊ1��3����д���÷�Ӧ�Ļ�ѧ����ʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��C(s)��O2(g)===CO2(g)����H1
CO2(g)��C(s)===2CO(g)�� ��H2
2CO(g)��O2(g)===2CO2(g)����H3
4Fe(s)��3O2(g)===2Fe2O3(s)�� ��H4
3CO(g)��Fe2O3(s)===3CO2(g)��2Fe(s)����H5
���й���������Ӧ�ʱ���ж���ȷ����
A. ��H1��0����H3��0B. ��H2��0����H4��0C. ��H1����H2����H3D. ��H3����H4����H5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о��绯ѧԭ���������ͼװ�á�������������ȷ����
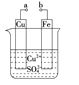
A��a��b������ʱ����Ƭ�ϻ��н���ͭ����
B��a��b�õ�������ʱ��ͭƬ�Ϸ����ķ�ӦΪ��Cu2����2e��===Cu
C������a��b�Ƿ����ӣ���Ƭ�����ܽ⣬��Һ������ɫ���dz��ɫ
D��a��b����ʱ��ͭƬ�Ϸ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu��������������������������Ҫ��Ӧ�á�
I.����Cu2O���Ǻ�ĸ��ͧ�ײ��ķ���ʴͿ�ϣ�Ҳ�������Ĵ�����
��1����֪��Cu2O(s)+![]() O2(g)=2CuO(s) ��H=-196kJ/mol
O2(g)=2CuO(s) ��H=-196kJ/mol
2C(s)+O2(g)=2CO(g) ��H=-220.8kJ/mol
��ҵ����̼����CuO��ĩ�����һ�������·�Ӧ��ȡCu2O(s)��ͬʱ����CO������Ȼ�ѧ����ʽΪ___��
��2��������Cu2O��������ʵ�ּ״�������ȡ��ȩ��CH3OH(g)![]() HCHO(g)+H2(g)���״���ƽ��ת�������¶ȱ仯������ͼ��ʾ��
HCHO(g)+H2(g)���״���ƽ��ת�������¶ȱ仯������ͼ��ʾ��
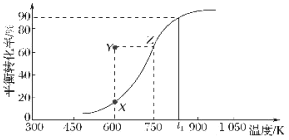
�ٸ÷�Ӧ����H___0������>������<������600Kʱ��Y��״���v������___v���棩������>������<������
����t1Kʱ����̶����Ϊ1L���ܱ������г���2molCH3OH(g)���¶ȱ��ֲ��䣬9����ʱ�ﵽƽ�⣬��0��9min����CH3OH(g)��ʾ�ķ�Ӧ����v(CH3OH)___���¶�Ϊt1ʱ���÷�Ӧ��ƽ�ⳣ��K��ֵΪ___��
II.Cu���dz����Ĵ��������dz����ĵ缫���ϡ�
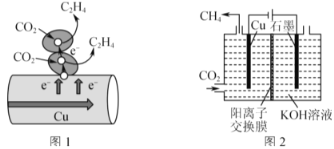
��3��ͼ1��ʾ��������CO2����ֱ�ӵ��Ӵ��ݻ��������ڴ���ͭ�ı������ת������ֱ�Ӵ��ݵĵ������ʵ���Ϊ2molʱ����μӷ�Ӧ��CO2�����ʵ���Ϊ___��
��4��ͼ2��ʾ��KOH��Һ���������Һ���е���ʾ��ͼ��CO2��Cu�缫�Ͽ���ת��ΪCH4���õ缫��Ӧ�ķ���ʽΪ___��
III.��ͭ���ӵķ�ˮ�������Ⱦ��ͨ������ת��Ϊ��ͭ��������ȥ��
��5����֪��Ksp(CuS)=1��10-36��Ҫʹͭ���ӵ�Ũ�ȷ����ŷű���������0.4mg/L������Һ�е������ӵ����ʵ���Ũ������Ϊ___mol/L��������С�����һλ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪN2��g����O2��g����Ӧ����NO��g�������е������仯������˵���������

A. �÷�Ӧ���Ȼ�ѧ����ʽΪ��N2��g��+O2��g���T2NO��g����H=+180kJ��mol��1
B. 1mol N2��l����NA��O2��l����Ӧ����2mol NO��g��ʱ�����յ�����Ϊ180kJ
C. 1mol N2��g����1mol O2��g�������������2mol NO��g�����������
D. ͨ������£�N2��g����O2��g����ϲ���ֱ������NO��g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��﮺�ˮ��س����ں��ϸ���������豸�У���ʾ��ͼ��ͼ��ʾ����ط�ӦΪ2Li��2H2O===2LiOH��H2������ع���ʱ������˵����������( )

A. �����������
B. ���Ӵ�﮵缫�������������缫
C. �ɽ�����ת��Ϊ��ѧ��
D. ��ˮ��Ϊ�������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤����ʵ�����Ʊ��õ���Cl2�л����HCl����ͬѧ�������ͼ��ʾ��ʵ��װ�ã���Ҫ��ش��������⡣

��1������ݼ�ͬѧ��ʾ��ͼ������ʵ��װ�ô������ҵ�����˳��װ�â���__________��
��2��װ�â�����Ҫ��������������__________��__________��__________��
��3��ʵ�����Ʊ�Cl2�����ӷ���ʽΪ____________��
��4��װ�â���Cu������__________���û�ѧ����ʽ��ʾ����
��5����ͬѧ��Ϊ��ͬѧʵ�������Ȼ����ȱ�ݣ�����֤������ͨ��AgNO3��Һ�е�����ֻ��һ�֡�Ϊ�ˣ���ͬѧ�������ͨ��װ�â�֮ǰ��Ҫ��װһ������װ�âݣ���֤������ͨ��AgNO3��Һ�е�����ֻ��һ�֡�����Ϊװ�â�Ӧ����__________��
��6����ͬѧ������ͬѧ��Ƶ�װ�ú����������װ�ã�ֻ�轫ԭ���ձ��е�AgNO3��Һ������ɫʯ����Һ������۲쵽__________��������֤����Cl2ʱ��HCl�ӷ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��д��ȷ����
A. 2SO2 + O2![]() 2SO3 ��H��-196.6 kJ��mol-1
2SO3 ��H��-196.6 kJ��mol-1
B. C(s) + O2(g) �� CO2(g) ��H��393.5 kJ��mol-1
C. H+(aq) + OH-(aq) �� H2O(l) ��H��57.3 kJ
D. ![]() H2(g) +
H2(g) + ![]() Cl2(g) �� HCl(g) ��H��-92.5 kJ��mol-1
Cl2(g) �� HCl(g) ��H��-92.5 kJ��mol-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com