
【题目】如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是

A. 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ·mol﹣1
B. 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ
C. 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g)
【答案】B
【解析】
A、△H=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,则反应N2(g)+O2(g)=2NO(g)的反应热△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,A正确;
B、由A可知,应该是1mol N2(g)和NA个O2(g)反应生成2mol NO(g)时,吸收的能量为180kJ,B错误;
C、N2(g)+O2(g)=2NO(g)△H=+180kJ/mol,为吸热反应,所以1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量,C正确;
D、通常情况下,N2(g)和O2(g)不能发生化学反应,一般需要高温或放电,D正确;
答案选B。
本题考查了反应能量变化的计算和判断,反应的焓变计算方法和能量守恒是解题的关键。注意反应热与键能以及物质总能量的关系。


科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列八种物质:①食盐晶体;②乙醇;③冰醋酸(纯醋酸晶体);④NaHSO4;⑤KNO3溶液;⑥熔融的氢氧化钠;⑦液态氯化氢;⑧Cl2。
(1)填空回答(填序号):
a、以上物质属于非电解质的是______。
b、以上物质可以导电的是________。
(2)写出④溶于水时的电离方程式________。
Ⅱ.按要求回答下列问题:
(1)等质量的CO2和CO:所含气体的分子数之比为_____;
(2)实验室里盛放氢氧化钠溶液的试剂瓶瓶塞不能用玻璃塞,用离子方程式表示其中的原因_____;
(3)我国政府为了消除碘缺乏病,规定在食盐中必须加人适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3 +KI+H2SO4 = K2SO4+ I2+H2O。
①将上面氧化还原反应的化学方程式配平___。
②如果反应中转移0.5mol电子,则生成I2的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下图所示的四个原电池装置,其中结论正确的是
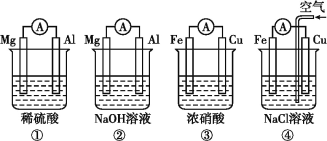
A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,电极反应式为6H2O+6e6OH+3H2↑
C. ③中Fe作负极,电极反应式为Fe3eFe3+
D. ④中Cu作正极,电极反应式为2H++2eH2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.化学电源在生产生活中有着广泛的应用,电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
(1)写出放电时负极的电极反应式:___;
(2)铅蓄电池放电时,溶液的pH将_________(填“增大”、“减小”或“不变”)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
(3)放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
Ⅱ.人们习惯上把电解饱和食盐水的工业叫做氯碱工业。如下图表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液。请回答以下问题:
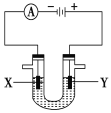
(4)X极上的电极反应式是:__________。
(5)检验Y电极反应产物的方法是_______。
(6)电解饱和NaCl溶液的离子方程式是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒主要用于冶炼特种钢, 被誉为 “合金的维生素”。工业上常用富钒炉渣 (主要含FeO·V2O3, 还有少量P2O5等杂质) 制取钒的流程如下图。
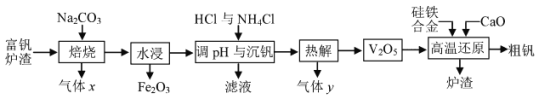
回答下列问题:
(1)已知焙烧中先发生4FeO·V2O3+5O2![]() 4V2O5+2Fe2O3反应, 其氧化产物是__,进一步生成可溶性NaVO3的反应方程式为______。
4V2O5+2Fe2O3反应, 其氧化产物是__,进一步生成可溶性NaVO3的反应方程式为______。
(2)25℃时,Ksp(NH4VO3)=4×10-2,电离平衡常数Kb(NH3·H2O) =1.8×10-5。“沉钒” 后VO3-的浓度为![]() mol/L,则滤液的pH为___。除OH-与VO3-外,滤液中还可能存在的阴离子是__。
mol/L,则滤液的pH为___。除OH-与VO3-外,滤液中还可能存在的阴离子是__。
(3) “热解” 过程产生的气体 y的电子式为__。
(4)硅参与高温还原反应的方程式为_____,炉渣的主要成分是__。
(5)钒比铁的金属性强。工业上通过电解精炼 “粗钒” 可得到99.5%的纯钒, 以熔融LiCl-KCl-VCl2为电解质,“粗钒” 中含少量铁和硅。则 “粗钒” 应连接电源的___极, 阴极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近20年来,对以氢气作为未来的动力燃料氢能源的研究得到了迅速发展。像电一样,氢是一种需要依靠其他能源,如石油、煤、原子能等的能量来制取的“二级能源”,而存在于自然界的可以提供现成形式能量的能源称为“一级能源”,如煤、石油、太阳能和原子能等。发展民用氢能源,首先必须制得廉价的氢气。
⑴氢气燃烧时耗氧量小,发热量大。已知热化学方程式为:
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
C(g)+O2(g)=CO2(g) △H=-393.5 kJ/mol
试通过计算说明等质量的氢气和碳燃烧时产生的热量的比值是________(保留两位小数)。
⑵某些科学家对以下3个反化学反应很感兴趣:
①3FeCl2+4H2O=Fe3O4+6HCl+H2
②2Fe3O4+3Cl2+12HCl=6FeCl3+6H2O+O2
③6FeCl3=6FeCl2+3Cl2
科学家研究上述反应意义在于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值为1:1 ⑦混合气体总质量 ⑧混合气体总体积
A. ①②③④⑤⑥⑦⑧B. ①③④⑤C. ①②③④⑤⑦D. ①③④⑤⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com