
 Sn(�ף�s)��H3����2��1 kJ��mol��1
Sn(�ף�s)��H3����2��1 kJ��mol��1| A����H1>��H2 |
| B�����ڳ������Ի���״̬���� |
| C������ת��Ϊ�����ķ�Ӧ�Ƿ��ȷ�Ӧ |
| D�����������ڴ��ڵ���13��2 ��Ļ����У������лٻ� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����H1>��H2>��H3 | B����H1<��H2<��H3 | C����H1����H2<��H3 | D����H1<��H2����H3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��+768 kJ/mol | B��-768 kJ/mol | C��+2342 kJ/mol | D��-2342 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 R(g) ��H = ��Q1 kJ��mol��1����2R (g)+N(g)
R(g) ��H = ��Q1 kJ��mol��1����2R (g)+N(g) 2T (g) ��H = ��Q2 kJ��mol��1�� Q1��Q2��Q3��Ϊ��ֵ������˵����ȷ����
2T (g) ��H = ��Q2 kJ��mol��1�� Q1��Q2��Q3��Ϊ��ֵ������˵����ȷ����| A��1 mol R(g)�������ܺʹ���1 mol M(s)��1 mol N(g) �������ܺ� |
| B����2 mol R (g)��1 mol N(g)�ڸ������³�ַ�Ӧ,�ų�����Q2 kJ |
C����1 mol M(s)��ȫת��ΪT (g)ʱ(�ٶ���������ʧ)���ų�����Q1+ kJ kJ |
D��M(g)+N(g) R(g) ��H=��Q3 kJ��mol��1 , ��Q3��Q1 R(g) ��H=��Q3 kJ��mol��1 , ��Q3��Q1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g)�����ȷ�Ӧ����������������ȷ����
2NH3(g)�����ȷ�Ӧ����������������ȷ����| A��N2��H2���е�������һ����NH3���е��������� |
| B��a��b��c���ߵĹ�ϵΪ��a+3b��2c |
| C�����ܱ�������ͨ��1molN2��3molH2����Ӧ�ų���������Ϊ(6c�Da�D3b)kJ |
| D���γ�1molN��H��ų�ckJ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������



 ������������±���ʾ��
������������±���ʾ��

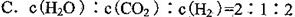

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A����֪CO��ȼ����Ϊ283 kJ/mol,2H2(g)��O2(g)===2H2O(g)����H����483.6 kJ/mol����ͼ�ױ�ʾCO��H2O(g)����CO2��H2�������仯 |
| B��ij�¶��£�pH��11��NH3��H2O��pH��1������������Ϻ�(�����ǻ�Ϻ���Һ����ı仯)ǡ����ȫ��Ӧ����Ӧ�����Һ��NH4+ ��NH3��H2O��NH3��������ƽ��Ũ��֮��Ϊ0.05 mol��L��1 |
| C���ڳ����£�X2(g)��H2��Ӧ����HX��ƽ�ⳣ�������ʾ��������K�ı仯���Ϳ���˵������ͬ�����£�ƽ��ʱX2(��F2��I2)��ת�������ͣ���X2��H2��Ӧ�ľ��ҳ̶����� |
D��ͼ�������߱�ʾ������������HA��ϡ��Һ�м�ˮϡ�����У� �ı仯��� �ı仯��� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com