
【题目】聚合碱式氯化铁[![]() (m为聚合度)为无机高分子絮凝剂,广泛应用于水处理。以铁矿石、氧化铁皮或
(m为聚合度)为无机高分子絮凝剂,广泛应用于水处理。以铁矿石、氧化铁皮或![]() 为原料,在酸性条件下经氧化、水解、聚合、熟化等步骤,可制得聚合碱式氯化铁。
为原料,在酸性条件下经氧化、水解、聚合、熟化等步骤,可制得聚合碱式氯化铁。
(1)钢铁酸洗废液中主要含有![]() 和
和![]() ,通入空气可制得
,通入空气可制得![]() ,反应的化学方程式________。氧化剂
,反应的化学方程式________。氧化剂![]() 也可以将
也可以将![]() 氧化成
氧化成![]() ,但存在的缺点是________________。
,但存在的缺点是________________。
(2)“氧化”过程中,若盐酸的浓度或投入量增大,除了会降低![]() 的转化率,还可能产生的影响为________________。
的转化率,还可能产生的影响为________________。
(3)①准确称取聚合碱式氯化铁样品1.5000g,置于250mL的锥形瓶中,加入适量稀盐酸,加热,迅速加入稍过量的![]() 溶液(
溶液(![]() 被
被![]() 氧化成为
氧化成为![]() ),充分反应后,多余的
),充分反应后,多余的![]() 用
用![]() 氧化除去。再加入适量的
氧化除去。再加入适量的![]() 组成的混酸及4~5滴指示剂,用
组成的混酸及4~5滴指示剂,用![]() 溶液滴定至终点(滴定过程中
溶液滴定至终点(滴定过程中![]() 与
与![]() 反应生成
反应生成![]() 和
和![]() ),消耗
),消耗![]() 溶液
溶液![]() 。
。
②另称取等质量的聚合碱式氯化铁样品溶于水中,配成500mL溶液,取25mL溶液于锥形瓶中,用铬酸钾(![]() )溶液作指示剂,用
)溶液作指示剂,用![]() 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗![]() 溶液8.10mL。
溶液8.10mL。
计算该样品中氯元素和铁元素的质量分数之比![]() 为________(写出计算过程,结果保留四位有效数字)。
为________(写出计算过程,结果保留四位有效数字)。
【答案】4FeCl2+O2+4HCl=4FeCl3+2H2O NaClO会与HCl反应产生Cl2,造成环境污染 过量的酸会抑制后续的水解、聚合反应的进行 1.712
【解析】
(1)钢铁酸洗废液中主要含有FeCl2和HCl,O2具有氧化性,亚铁离子具有还原性,通入空气可制得FeCl3,反应的化学方程式4FeCl2+O2+4HCl=4FeCl3+2H2O。氧化剂NaClO也可以将![]() 氧化成
氧化成![]() ,但次氯酸根离子和氯离子会在酸性条件下发生归中反应,生成氯气,污染环境。故存在的缺点是NaClO会与HCl反应产生Cl2,造成环境污染。故答案为:4FeCl2+O2+4HCl=4FeCl3+2H2O;NaClO会与HCl反应产生Cl2,造成环境污染;
,但次氯酸根离子和氯离子会在酸性条件下发生归中反应,生成氯气,污染环境。故存在的缺点是NaClO会与HCl反应产生Cl2,造成环境污染。故答案为:4FeCl2+O2+4HCl=4FeCl3+2H2O;NaClO会与HCl反应产生Cl2,造成环境污染;
(2)制备聚合碱式氯化铁,涉及到铁离子水解,溶液显酸性,最终产物中还含有一定的氢氧根离子,若盐酸的浓度或投入量增大,不利于水解和最终的聚合。“氧化”过程中,若盐酸的浓度或投入量增大,除了会降低![]() 的转化率,还可能产生的影响为过量的酸会抑制后续的水解、聚合反应的进行。故答案为:过量的酸会抑制后续的水解、聚合反应的进行;
的转化率,还可能产生的影响为过量的酸会抑制后续的水解、聚合反应的进行。故答案为:过量的酸会抑制后续的水解、聚合反应的进行;
(3)由②n(Cl-)=![]() ×0.05000mol·L-1×8.1×10-3L=8.100×10-3mol;
×0.05000mol·L-1×8.1×10-3L=8.100×10-3mol;
由①Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,用0.02000mol·L-1 K2Cr2O7溶液滴定生成的Fe2+(K2Cr2O7被还原为Cr3+),直至终点消耗K2Cr2O7)溶液25.00mL,反应中的定量关系可知,n(Fe3+)=6n(Cr2O72-)=6×0.02000mol·L-1×25×10-3L=3.000×10-3mol;
该样品中氯元素和铁元素的质量分数之比![]() =8.100×10-3mol×35.5g·mol-1:3.000×10-3mol×56g·mol-1=1.712。
=8.100×10-3mol×35.5g·mol-1:3.000×10-3mol×56g·mol-1=1.712。
故答案为:1.712。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题(Cl2易溶于CCl4)。

(1)若用含有7.3 g HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2质量总是小于3.55 g的原因是________________________________。
(2)①装置B中盛放的试剂名称为________________,作用是________________________________,现象是_____________________________。
②装置D和E中出现的不同现象说明的问题是___________________。
③装置F的作用是__________________________________________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在________与________之间(填装置字母序号),装置中应放入________(填写试剂或用品名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2 mol A和1 mol B,乙中充入2 mol C和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
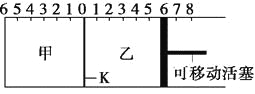
A. 根据隔板K滑动与否可判断左右两边的反应是否达到平衡
B. 达到平衡后,隔板K最终停留在左侧刻度0~2之间
C. 达到平衡时,甲容器中C的物质的量大于乙容器中C的物质的量
D. 若平衡时K停留在左侧1处,则活塞仍停留在右侧6处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:

已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
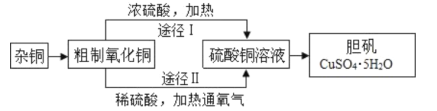
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于___上(用以下所给仪器的编号填入,下同),取用坩埚应使用____,灼烧后的坩埚应放在___上,不能直接放在桌面上;实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹;
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾,灼烧后含有少量铜的可能原因是____;
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径 II 实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、____、冷却结晶、___、自然干燥;
(4)由粗制氧化铜通过两种途径制取胆矾,与途径I相比,途径II有明显的两个优点是: ____、____;
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行___次;
(6)若测定结果x值偏高, 可能的原因是___。
a.加热温度过高 b.胆矾晶体的颗粒较大 c.加热后放在空气中冷却 d.胆矾晶体部分风化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2mol·L-1A气体和1mol·L-1B气体混合,并在一定条件下发生反应:2A(g)+B(g)![]() 2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质B表示的反应的平均速率为0.6mol·L-1·s-1
②用物质A表示的反应的平均速率为0.3mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L-1
其中正确的是( )
A.① ③B.③ ④C.② ③D.② ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 molX和3molY在容器中发生2X(?)+3Y(气)![]() 3Z(?)反应已达平衡状态,若增加压强或降低温度,Y的体积分数都减小,则下列说法正确的是( )
3Z(?)反应已达平衡状态,若增加压强或降低温度,Y的体积分数都减小,则下列说法正确的是( )
A. 可能X、Z均是气体,也可能X、Z都不是气体。正反应放热
B. 可能X是气体,Z不是气体,正反应放热
C. 可能X是气体,Z是气体,正反应吸热
D. X、Z一定都是气体,正反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3和NaHCO3性质的说法不正确的是( )
A.热稳定性:NaHCO3<Na2CO3
B.在水中的溶解性:NaHCO3<Na2CO3
C.与盐酸反应的速率:NaHCO3<Na2CO3
D.等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应产生的CO2质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将充满NO2和O2的试管倒立于水槽中,充分反应后,剩余气体的体积为原混合气体体积的![]() ,则原混合气体中NO2和O2的体积之比是
,则原混合气体中NO2和O2的体积之比是
A.8:1B.7:3C.1:7D.4:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com