
����ZnO�������ϡ�Ϳ�Ϲ�ҵ������ҪӦ�ã�һ���ɴ�ZnO(��FeO��CuO)�Ʊ�����ZnO����������(��֪����ʽ̼��п�����տ��Ƶû���ZnO)��

��֪�������������������������ʱ��pH�����

��ش��������⣺
(1)����A��H2O2������Ӧ�����ӷ���ʽ�� ���ò����������ҺpH�ķ�Χ�� ��
(2)A��Һ����Ҫ���е������� ��
(3)��ʽ̼��п�������Ƶû���ZnO�ķ�Ӧ��H��0���÷�Ӧ���Է����е�ԭ���Ǧ�S (ѡ�=��������������)0��
(4)����������ķ�ˮpH=8����ʱZn2+��Ũ��Ϊ mg/L(�����£�Ksp��Zn(OH)2��=1.2��10-17)��
(1)2Fe2++H2O2+2H+=2Fe3++2H2O 3.2��5.2 (2)(NH4)2SO4 (3)�� (4)0.78
��������(1)����A����H2O2��Ŀ���ǽ�Fe2+����ΪFe3+���ڳ�ȥ��ͬʱ�������µ����ʡ�������ͼ�����ò�����ֻ����Fe(OH)3��������ϱ������ݿ�֪�������ҺpHΪ3.2��5.2֮�䡣
(2)����п��Һ�м���̼����狀����ɼ�ʽ̼��п����������李�
(3)��Ӧ�Է����Ҧ�H��0,��S�ش���0��
(4)��c(Zn2+)��c2(OH-)=Ksp
c(Zn2+)=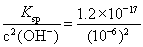 =1.2��10-5 (mol��L-1),��1.2��10-5 mol��L-1��65 g��mol-1=7.8��10-4 g��L-1,��0.78 mg��L-1
=1.2��10-5 (mol��L-1),��1.2��10-5 mol��L-1��65 g��mol-1=7.8��10-4 g��L-1,��0.78 mg��L-1


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014�껯ѧ�߿���ʱ����10������ϩ��úʯ����Ȼ�����ۺ�������ϰ���������棩 ���ͣ�ѡ����
����ʽΪC3H6Cl2��ͬ���칹�干��(�����������칹)��( )
A.3�֡�����B.4�֡�����C.5�֡�����D.6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�껯ѧ�߿��ܸ�ϰ��ʱ����3-4����������; ��������������ϰ���������棩 ���ͣ�ѡ����
��ʮ���塱��2011��2015�꣩ĩ�ڣ�������·�Ľ��跢չ��һƱ�����������Ӹ����ϵõ��Ĺۣ�����˵����Ϊ��ʷ�������й�˵������ȷ���ǣ� ��
A����·��������Ĵ���ˮ�������������ǽ�������
B����·��̽ʱ����̫���ܵ���ṩ������̫���ܵ����ԭ���
C�����캸��ʱ���õ����ȷ�Ӧ�����ȷ�Ӧ�зų�������������ʹ���ۻ�
D����ҵ���������ұ���������Ȼ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�껯ѧ�߿��ܸ�ϰ��ʱ���� 8-4���ܵ���ʵ��ܽ�ƽ����ϰ���������棩 ���ͣ������
������25��ʱ�������ܵ���ʵ��ܽ�ȣ�
���ݵ���� | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
�ܽ��/g | 9��10-4 | 1.7��10-6 | 1.5��10-4 | 3.0��10-9 |
������������ᴿ�У����������ܵ���ʵ��ܽ�ƽ��ԭ����ȥijЩ���ӡ����磺
��Ϊ�˳�ȥ�Ȼ���е�����Fe3�����Ƚ����������ˮ������һ�������Լ���Ӧ�����˺�ᾧ��
��Ϊ�˳�ȥ�Ȼ�þ�����е�����Fe3�����Ƚ����������ˮ������������Mg(OH)2����ַ�Ӧ�����˺�ᾧ��
��Ϊ�˳�ȥ����ͭ�����е�����Fe2�����Ƚ����������ˮ������һ������H2O2����Fe2��������Fe3����������Һ��pH��4�����˺�ᾧ��
��ش��������⣺
(1)�������ֳ��ӷ������ܹ��ﵽ�ܺõ�Ч����Fe2����Fe3������ת��Ϊ ����ȥ��
(2)���м�����Լ�Ӧ��ѡ�� Ϊ�ˡ�
(3)���г�ȥFe3�����������ܷ�Ӧ�����ӷ���ʽΪ ��
(4)�����뷽������ص������У���ȷ���� (����ĸ)��
A��H2O2����ɫ�������������������в��������ʡ���������Ⱦ
B����Fe2������ΪFe3������Ҫԭ����Fe(OH)2������Fe(OH)3�������ѹ���
C��������ҺpH��4��ѡ����Լ���������ͭ���ʽ̼��ͭ
D��Cu2+���Դ���������pH��4����Һ��
E����pH��4����Һ��Fe3��һ�����ܴ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�껯ѧ�߿��ܸ�ϰ��ʱ���� 8-4���ܵ���ʵ��ܽ�ƽ����ϰ���������棩 ���ͣ�ѡ����
������BaCO3�ֱ���룺
��30 mLˮ
��10 mL 0.2 mol/L Na2CO3��Һ
��50 mL 0.01 mol/L�Ȼ�����Һ
��100 mL 0.01 mol/L�������ܽ�����Һ���͡�����Һ��Ba2+��Ũ���ɴ�С��˳��Ϊ( )
A���٢ڢۢ� B���ۢܢ٢� C���ܢۢ٢� D���ڢ٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�껯ѧ�߿��ܸ�ϰ��ʱ���� 8-3�����ˮ����ϰ���������棩 ���ͣ�ѡ����
��֪�ڳ����²��Ũ�Ⱦ�Ϊ0.1 mol��L-1������������Һ��pH��

����˵������ȷ����( )
A.�����ӵ����ʵ���Ũ��֮�ͣ�Na2CO3��NaCN��NaHCO3
B.��ͬ�����µ����ԣ�H2CO3<HCN
C.������Һ�о����ڵ���ƽ���ˮ��ƽ��
D.����Na2CO3��Һ���¶ȣ� ��С
��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�껯ѧ�߿��ܸ�ϰ��ʱ���� 8-3�����ˮ����ϰ���������棩 ���ͣ�ѡ����
��ͼ��ʾij���ʷ�������( )

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�껯ѧ�߿��ܸ�ϰ��ʱ���� 8-1������ʵĵ�����ϰ���������棩 ���ͣ�ѡ����
��֪����ʱ��0.1 mol/LijһԪ��HA��ˮ����0.1%�������룬���������������( )
A.����Һ��pH=4
B.�����¶ȣ���Һ��pH����
C.����ĵ���ƽ�ⳣ��ԼΪ1��10-7
D.��HA�������c(H+)ԼΪˮ�������c(H+)��106��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�껯ѧ�߿��ܸ�ϰ��ʱ���� 6��ѧ��Ӧ��������ϰ���������棩 ���ͣ�ѡ����
��ͼ��ʾ����H1=��393��5 kJ��mol-1����H2=��395��4 kJ��mol-1������˵�����ʾʽ��ȷ���ǣ� ��

A��C��s��ʯī��=C��s�����ʯ�� ��H=+1��9 kJ��mol-1
B��ʯī�ͽ��ʯ��ת���������仯
C�����ʯ���ȶ���ǿ��ʯī
D��1 molʯī��������1 mol���ʯ����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com