
【题目】用pH传感器测得0.10mol/LNa2CO3溶液从55℃升高至85℃的pH如图所示。在55℃升高至85℃升温过程中,下列说法正确的是( )
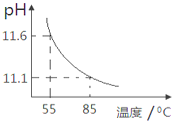
A.c(H+)增大,c(OH-)减小 B.c(CO32-)/c(HCO3-)比值不断增大
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.10 D.c(OH-)-c(HCO3-)-c(H2CO3)=10-11.1
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,不属于取代反应的是
A. ![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
B. CH2=CH2+Br2 ![]() BrCH2CH2Br
BrCH2CH2Br
C. CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
D. CH3CH2CH2Br+NaOH![]() CH3CH2CH2OH+NaBr
CH3CH2CH2OH+NaBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____区元素,其基态原子的价电子排布式为_____。
(2)基态Na原子中,核外电子占据的原子轨道总数为____,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____(用元素符号表示)。
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________,1mol碳酸丙烯酯中键的数目为________.

(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____,该配离子包含的作用力为__(填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为_____cm(用含ρ、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置来分离CO2和CO混合气体并干燥,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为()

甲 | 乙 | 丙 | |
A | 饱和NaHCO3溶液 | 12 mol·L-1盐酸 | 18.4 mol·L-1 H2SO4 |
B | 饱和Na2CO3溶液 | 2 mol·L-1 H2SO4 | 饱和NaOH溶液 |
C | 饱和NaOH溶液 | 2 mol·L-1 H2SO4 | 18.4 mol·L-1 H2SO4 |
D | 18.4 mol·L-1 H2SO4 | 饱和NaOH溶液 | 18.4 mol·L-1 H2SO4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质沸点由高到低的顺序是
①正丁烷 ②2—甲基丙烷 ③丙烷 ④2,2—二甲基丙烷
A. ④②①③B. ④①②③C. ②④①③D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述正确的是( )
A.  若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右
若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右
B.  表示反应4CO(g)+2NO2(g)N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
表示反应4CO(g)+2NO2(g)N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
C.  表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数
表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数
D.  表示25℃时,向0.1 molL﹣1的NH4Cl溶液中滴加0.1 molL﹣1的盐酸,溶液中c(H+)/c(NH4+)随盐酸体积的变化关系
表示25℃时,向0.1 molL﹣1的NH4Cl溶液中滴加0.1 molL﹣1的盐酸,溶液中c(H+)/c(NH4+)随盐酸体积的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g) ![]() 2NO(g)+O2 (g) (正反应吸热)。实验测得:v正= v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2 (g) (正反应吸热)。实验测得:v正= v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是

A. 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为4∶5
B. 达平衡时,容器Ⅱ中c(O2)/c(NO2)比容器Ⅰ中的大
C. 达平衡时,容器Ⅲ中NO的体积分数小于50%
D. 当温度改变为T2时,若k正=k逆,则 T2> T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中过量的氨氮(NH3和NH4+)会导致水体富营养化。某科研小组用NaClO氧化法处理氨氮废水。已知:①HClO的氧化性比NaClO强;②NH3比NH4+更易被氧化;③国家标准要求经处理过的氨氮废水pH要控制在6~9。
(1)pH=1.25时,NaClO可与NH4+反应生成N2等无污染物质,该反应的离子方程式为_____。
(2)进水pH对氨氮去除率和出水pH的影响如下图所示

①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降的原因是_____
②进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是_____
③进水pH应控制在_____左右为宜。
(3)为研究空气对NaClO氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是_____(填字母)。
a.O2的氧化性比NaClO弱 b.O2氧化氨氮速率比NaClO慢
c.O2在溶液中溶解度比较小 d.空气中的N2进入溶液中
(4)利用微生物燃料电池可以对氨氮废水进行处理,其装置如图所示。闭合电路后,负极室与正极室均产生氮气,则负极室中NH4+发生反应的电极反应式为_____。该装置除了能对氨氮废水进行处理外,另一个突出的优点是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中有如下反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-906 kJ·mol-1,下列叙述正确的是
4NO(g)+6H2O(g) ΔH=-906 kJ·mol-1,下列叙述正确的是
A. 2 mol NH3和5 mol O2充分反应,达到平衡时放出热量为453 kJ
B. 平衡时5v正(O2)=4v逆(NO)
C. 平衡后降低温度,混合气体中NH3含量减小
D. 平衡后减小压强,混合气体平均摩尔质量增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com