
【题目】1 mol 苯乙烯(![]() )在不同条件下与H2发生加成反应时,产物存在差异:
)在不同条件下与H2发生加成反应时,产物存在差异:
条件 | 消耗氢气 | 加成产物 | |
① | 室温、低压、催化剂 | 1 mol |
|
② | 高温、高压、催化剂 | 4 mol |
|
下列说法正确的是
A.两种条件下的加成产物都属于芳香烃
B.两种条件下的加成产物都能使酸性高锰酸钾溶液褪色
C.两种条件下的加成产物都能在光照条件下与溴进行取代
D.该现象说明侧链上的碳碳双键比苯环内的碳碳双键更活泼
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用如图所示实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)回答下列问题:
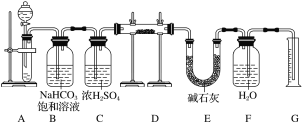
(1)装置A是用来产生CO2气体,则A中液体试剂选用____________,发生反应的离子方程式为___________________。
(2)装置B的作用是_____________________________________________________,装置C的作用是________________________________________________________,装置E中碱石灰的作用是_________________________________________________。
(3)装置D中发生反应的化学方程式为________________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。
(1)预测钾的化学性质,完成下列反应的化学方程式:
①钾在氯气中燃烧____________________________;
②点燃钾剧烈燃烧_____________________________;
③将小块钾投入冷水中______________________________;
(2)推测钾在自然界中的存在方式是(填“游离态”或“化合态”)________。
(3)该小组研究钾的性质时用到的主要方法有____________________________________。
(4)他们研究金属钾性质的程序是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中。KI还可用于分析试剂、感光材料、制药等,其制备原理如下:
反应I:3I2+ 6KOH== KIO3 +5KI+ 3H2O
反应II:3H2S+KIO3=3S↓+KI+ 3H2O
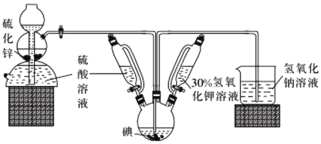
请回答有关问题。
(1)启普发生器中发生反应的化学方程式为________。装置中盛装30%氢氧化钾溶液的仪器名称是__________。
(2)关闭启普发生器活塞,先滴入30%的KOH溶液.待观察到三颈烧瓶中溶液颜色由棕黄色变为______(填现象),停止滴人KOH溶液;然后________(填操作),待三颈烧瓶和烧杯中产生气泡的速率接近相等时停止通气。
(3)滴入硫酸溶液,并对三颈烧瓶中的溶液进行水浴加热,其目的是_______________。
(4)把三颈烧瓶中的溶液倒入烧杯中,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还含有硫酸钡和____(填名称)。合并滤液和洗涤液,蒸发至析出结晶,干燥得成品。
(5)实验室模拟工业制备KIO3流程如下:
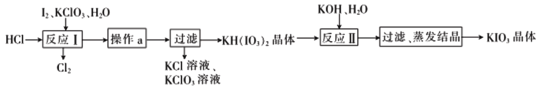
几种物质的溶解度见下表:
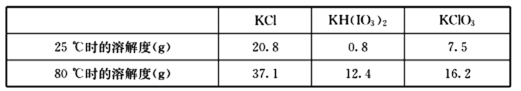
用惰性电极电解KI溶液也能制备KIO3,与电解法相比,上述流程制备KIO3的缺点是_________。
(6)某同学测定.上述流程生产的KIO3样品的纯度。
取1.00 g样品溶于蒸馏水中并用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加2.0 mol·L-1 Na2S2O3溶液,恰好完全反应时共消耗12. 60 mL Na2S2O3溶液。该样品中KIO3的质量分数为___________(已知反应:I2+2Na2S2O3=2NaI+Na2S4O6)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有以下分子式的一溴代烷的所有同分异构体,水解后的产物,经催化氧化最多生成4种醛,则该一溴代烷的分子式可能是( )
A.C6H13BrB.C5H11BrC.C4H9BrD.C3H7Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好,以煤为原杵在不同条件下可合成下列物质(部分条件未标出),C是一种植物生长调节剂,用它可以催熟果实。根据以下化学反应框图填空:
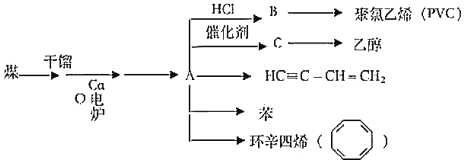
(1)写出A的电子式_____;C的空间构型为平面结构,键角约为_____。
(2)写出乙醇在Cu催化下与O2反应时的方程式_____。
(3)B中所含官能团的名称是_____。
(4)若分别完全燃烧等质量的HC=C—CH=CH2和乙炔,所需氧气的量_____(选填“前者多”“后者多”“一样多”)。
(5)苯乙烯(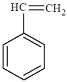 )与环辛四烯互为同分异构体,写出由苯乙烯合成聚苯乙烯的化学方程式_____。
)与环辛四烯互为同分异构体,写出由苯乙烯合成聚苯乙烯的化学方程式_____。
(6)异丙苯(![]() )是苯的同系物。由苯与2—丙醇反应制备异丙苯属于_____反应;由异丙苯制备对溴异丙苯的反应试剂和反应条件为_____。
)是苯的同系物。由苯与2—丙醇反应制备异丙苯属于_____反应;由异丙苯制备对溴异丙苯的反应试剂和反应条件为_____。
(7)异丙苯有多种同分异构体,其中一溴代物最少的芳香烃的结构简式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃是一类重要的有机合成中间体,如图是由物质A引发的系列生成卤代烃的反应,请回答下列问题:

(1)根据系统命名法,化合物A的名称是_____。
(2)如图中,反应③是反应_____。
(3)C1的结构简式是_____。F1的结构简式是_____。
(4)化合物E是重要的工业原料,写出由D生成E的化学方程式:_____。
(5)检验B中的氯元素的方法为_____。
(6)设计一条以环己醇(![]() )为原料(其他无机试剂任取)合成
)为原料(其他无机试剂任取)合成![]() 的合成路线_____。(合成路线常用的表示方式为:A
的合成路线_____。(合成路线常用的表示方式为:A![]() B
B![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. CCl4和SiCl4的熔点
B. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
C. I2在水中的溶解度和I2在CCl4溶液中的溶解度
D. H2SO3和H2SO4的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是工业生产中不可缺少的一种金属。请回答下列问题:
(1)Fe元素在元素周期表中的位置是__。
(2)Fe有δ、γ、α三种同素异形体,其晶胞结构如图所示:
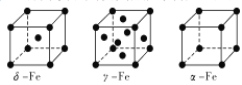
①δ、α两种晶体晶胞中铁原子的配位数之比为__,γ晶胞中实际拥有___个原子。
②若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为___g/cm3(列出算式即可)。
(3)三氯化铁在常温下为固体.熔点为282℃,沸点为315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为___。
(4)氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。
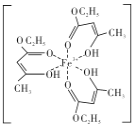
①此配合物中碳原子的杂化轨道类型有___。
②此配离子中含有的化学键有___(填字母代号)。
A.离子键 B.金属键 C.极性键 D.非极性键
E.配位键 F.氢键 G.δ键 H.π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com