
【题目】下列反应中Cl元素全部被氧化的是
A.KClO3+6HCl=KCl+3Cl2↑+3H2O
B.2NaCl电解2Na+Cl2↑
C.H2+Cl2光照2HCl
D.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
科目:高中化学 来源: 题型:
【题目】下列实验中,对于杂质(括号中的物质为杂质)的检验和除杂方法均正确的是( )
选项 | 目标物质和杂质 | 检验方法 | 除杂方法 |
A | FeCl2(FeCl3) | 滴入KSCN | 通入过量氯气 |
B | NaCl(NH4Cl) | 加热 | 加热 |
C | KNO3(NaCl) | 焰色反应(透过蓝色钴玻璃) | 重结晶 |
D | Cl2(HCl) | 通入AgNO3溶液 | 通入饱和NaCl溶液中 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)原子核外有3个电子层,其价电子数为7的元素其最高价氧化物对应水化物化学式________,其单质与NaOH反应的化学方程式为____________________________________________________。
(2)已知X+、Y2+、Zˉ、W2ˉ四种离子均具有相同的电子层结构,则X、Y、Z、W这四种元素的原子序数由大到小的顺序是___________________,原子半径由大到小的顺序是__________________。
(3) A+、Bˉ、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++Bˉ![]() C+D↑,则A+、Bˉ的电子式:_____________ ,______________;比较C和D的稳定性的强弱:_____________________(用化学式表示)。
C+D↑,则A+、Bˉ的电子式:_____________ ,______________;比较C和D的稳定性的强弱:_____________________(用化学式表示)。
(4)①NH4NO3 ②NaF ③CO2 ④K2O2 ⑤NaOH ⑥CH4
以上只含有极性键的是_______(填序号),既有离子键又有非极性键的是______(填序号);既有离子键又有极性键的是______(填序号)。
(5)下列原子:![]() 中共有____种元素,__种核素。
中共有____种元素,__种核素。
(6)写出下列物质或微粒的电子式:
①CO2__________②KCl_____________③H2O2_______________④N2_____________;
⑤用电子式表示MgCl2的形成过程_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4![]() H2O):
H2O):![]()
NaClO过量时,易发生反应:![]()
实验一:制备NaClO溶液(实验装置如图甲所示)

锥形瓶中发生反应的离子方程式是__________________。
实验二:制取水合肼(实验装置如图乙所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114℃馏分。
分液漏斗中的溶液是_____________(填序号);
A、CO(NH2)2溶液 B、NaOH溶液 C、NaOH和CO(NH2)2混合溶液 D、NaOH和NaClO混合溶液
选择的理由是_________________。
实验三:测定馏分中肼含量
称取馏分5.000g加入适量NaHCO3固体,加入配成250mL溶液,移出25.00mL,用0.1000mol/L的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右(已知:N2H4![]() H2O+2I2═N2↑+4HI+H2O)。
H2O+2I2═N2↑+4HI+H2O)。
配制250mL溶液所需仪器除分析天平、烧杯、玻璃棒外,还需______________。
滴定过程中,NaHCO3能控制溶液的pH在6.5左右,用离子方程式解释其原因:__________。
实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4![]() H2O)的质量分数为____________。
H2O)的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.糖类化合物都具有相同的官能团
B.酯类物质是形成水果香味的主要成分
C.油脂的皂化反应生成脂肪酸和丙醇
D.蛋白质的水解产物都含有羧基和羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B的单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
A | 932 | 1 821 | 15 390 | 21 771 |
B | 738 | 1 451 | 7 733 | 10 540 |
(1)某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背了________。
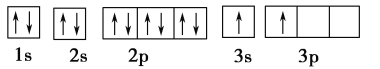
(2)ACl2分子中A原子的杂化类型为________。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C—C键的键长大于C60中C—C键的键长,有同学据此认为C60的熔点高于金刚石,你认为是否正确________(填“是”或“否”),并阐述理由______________________________。
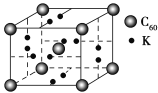
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式______________,该物质的K原子和C60分子的个数比为________。
(5)继C60后,科学家又合成了Si60、N60等,C、Si、N元素的电负性由大到小的顺序是______________________________,NCl3分子的VSEPR模型为________。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中π键的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质混合后,不会发生离子反应的是( )
A.NaOH溶液和FeCl3溶液
B.Na2CO3溶液和稀硫酸
C.Na2SO4溶液和MgCl2溶液
D.CuSO4溶液和Ba(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学与生活密切相关,下列说法不正确的是 _________
A. 抗酸药能中和胃里过多的盐酸,缓解胃部不适
B. 柠檬因为有酸味,所以属于酸性食品
C. 目前加碘食盐中碘元素以KIO3形式存在
D. 利用油脂在碱性条件下的水解,可以制甘油和肥皂
(2)化学与生活息息相关。下列叙述正确的是 _________
A. 土豆的淀粉经水解可变成酒 B. 油脂经水解可变成葡萄糖
C. 鲜榨橙汁遇到碘水会变蓝 D. 馒头越嚼越甜
(3)纤维素被称为“第七营养素”。食物中的纤维素虽然不能被消化,但能刺激肠道蠕动和分泌消化液,有助于食物的消化和废物的排泄。在化学分类中,纤维素属于_________
A.蛋白质 B.脂肪 C.多糖
(4)某种食品的配料标签如图所示:

①其中,富含蛋白质的物质是______,富含油脂的物质是______,有防腐作用的是______。
②用于包装该食品的聚乙烯塑料包装属于______(填字母)。
A.有机高分子材料 B.无机非金属材料 C.金属材料
③大量使用塑料包装,会造成“____污染”,这种包装袋属于______(可回收资源 / 不可回收资源)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是

A. 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
B. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸
C. 1mol乙酸与1mol乙醇充分反应达限度时,得到的乙酸乙酯小于1mol
D. 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com