
【题目】芳香化合物A(C9H9O3Br)可以发生如图所示的转化,合成两种重要的高分子化合物G和H(其他产物和水已略去)。

已知A遇氯化铁溶液显紫色,请回答下列问题:
(1)B的结构简式为____________,其核磁共振氢谱图显示有______种不同环境的氢原子。
(2)D的名称是________________;C和E生成H的反应类型为 _______________
(3)1molA与足量NaOH 溶液充分反应,消耗NaOH的物质的量为____________
(4)C生成D的化学方程式为________________________
(5)W是B的同系物,比B多一个碳原子, 符合下列条件的W的同分异构体有______种。
①遇氯化铁溶液显紫色
②既能发生水解反应又能发生银镜反应
(6)参照上述合成路线,根据信息,以乙醇为原料(无机试剂任选)设计制备 的合成路线_______________
的合成路线_______________
ⅰ.![]()
![]()
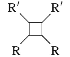
![]() +H2O(R1、R2为烃基或氢)
+H2O(R1、R2为烃基或氢)
ⅱ.R-HC![]() CH-R'
CH-R'![]()
【答案】![]() 4 乙二醛 缩聚反应 3mol HOCH2CH2OH+O2
4 乙二醛 缩聚反应 3mol HOCH2CH2OH+O2![]() OHCCHO + 2H2O 13
OHCCHO + 2H2O 13 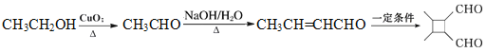
【解析】
由G可知B的结构简式为![]() ,A遇氯化铁溶液变紫色,说明A中含有酚羟基,C中不饱和度为
,A遇氯化铁溶液变紫色,说明A中含有酚羟基,C中不饱和度为![]() =0,说明C中不含双键,则C结构简式为HOCH2CH2OH,A发生水解反应生成B、C,结合A分子式知,A结构简式为
=0,说明C中不含双键,则C结构简式为HOCH2CH2OH,A发生水解反应生成B、C,结合A分子式知,A结构简式为![]() ;C被氧化生成D,D结构简式为OHCCHO,D和新制氢氧化铜悬浊液发生氧化反应然后酸化得到E,E为HOOCCOOH,E和甲醇发生酯化反应生成F,F为CH3OOCCOOCH3,H为C、E发生缩聚反应生成高分子,H为
;C被氧化生成D,D结构简式为OHCCHO,D和新制氢氧化铜悬浊液发生氧化反应然后酸化得到E,E为HOOCCOOH,E和甲醇发生酯化反应生成F,F为CH3OOCCOOCH3,H为C、E发生缩聚反应生成高分子,H为![]() ;
;
(6)由已知信息ⅱ可知制备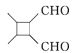 应有CH3CH=CHCHO发生分子内加成反应即可,而CH3CHO发生信息ⅰ的反应即可得到CH3CH=CHCHO,再结合乙醇催化氧化生成CH3CO即可解答。
应有CH3CH=CHCHO发生分子内加成反应即可,而CH3CHO发生信息ⅰ的反应即可得到CH3CH=CHCHO,再结合乙醇催化氧化生成CH3CO即可解答。
(1)由分析知B的结构简式为![]() ,其核磁共振氢谱图显示有4种不同环境的氢原子;
,其核磁共振氢谱图显示有4种不同环境的氢原子;
(2)D结构简式为OHCCHO,D的名称是乙二醛;乙二醇和乙二酸通过缩聚反应生成的H为聚乙二酸乙二酯,则反应类型为缩聚反应;
(3)由分析知A为![]() ,其与足量NaOH水溶液在加热条件下发生反应的方程式为
,其与足量NaOH水溶液在加热条件下发生反应的方程式为![]() ,则1molA与足量NaOH 溶液充分反应,消耗NaOH的物质的量为3mol;
,则1molA与足量NaOH 溶液充分反应,消耗NaOH的物质的量为3mol;
(4)C生成D的反应为乙二醇催化氧化生成乙二醛,发生反应的化学方程式为HOCH2CH2OH+O2![]() OHCCHO + 2H2O;
OHCCHO + 2H2O;
(5)B是![]() ,W是B的同系物,比B多一个碳原子,且符合下列条件:①遇氯化铁溶液显紫色,说明含有酚羟基;②既能发生水解反应又能发生银镜反应,说明为甲酸酯,即含有HCOO-;则:①分子结构中含有酚羟基和HCOOCH2-,共有3种结构;②分子结构中含有酚羟基、HCOO-和-CH3,其中酚羟基与甲基在邻位共有4种,酚羟基与甲基在间位共有4种,酚羟基与甲基在对位共有2种;故满足条件的W共有3+4+4+2=13种;
,W是B的同系物,比B多一个碳原子,且符合下列条件:①遇氯化铁溶液显紫色,说明含有酚羟基;②既能发生水解反应又能发生银镜反应,说明为甲酸酯,即含有HCOO-;则:①分子结构中含有酚羟基和HCOOCH2-,共有3种结构;②分子结构中含有酚羟基、HCOO-和-CH3,其中酚羟基与甲基在邻位共有4种,酚羟基与甲基在间位共有4种,酚羟基与甲基在对位共有2种;故满足条件的W共有3+4+4+2=13种;
(6)由已知信息ⅱ可知制备 应有CH3CH=CHCHO发生分子内加成反应即可,而CH3CHO发生信息ⅰ的反应即可得到CH3CH=CHCHO,另外乙醇催化氧化生成CH3CHO,则以乙醇为原料制备
应有CH3CH=CHCHO发生分子内加成反应即可,而CH3CHO发生信息ⅰ的反应即可得到CH3CH=CHCHO,另外乙醇催化氧化生成CH3CHO,则以乙醇为原料制备 的合成路线为
的合成路线为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液实验如表所示:
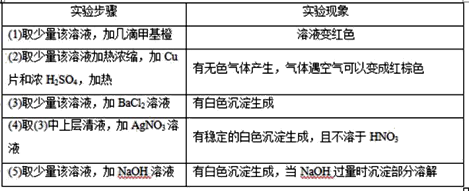
由此判断:
(1)溶液中肯定存在的离子是________________,溶液中肯定不存在的离子是________________________。
(2)为进一步确定其他离子,应该补充的实验及对应欲检离子的名称_______(如为溶液反应,说明使用试剂的名称,不必写详细操作步骤)______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通如图所示。容器中发生以下反应:N2+3H2![]() 2NH3(正反应为放热反应)。若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:
2NH3(正反应为放热反应)。若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:
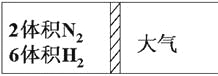
(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各物质的体积仍与上述平衡时完全相同,那么:
①若a=1,c=2,则b=____。在此情况下,反应起始时将向______(填“正”或“逆”)反应方向进行。
②若需规定起始时反应向逆反应方向进行,则c的范围是______。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是______,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2+3H2 ![]() 2NH3刚开始时,N2的浓度为3mol·L-1 ,H2的浓度为5mol·L-1,3min后测得NH3的浓度为0.6mol·L-1则此时间内,下列反应速率表示正确的是( )
2NH3刚开始时,N2的浓度为3mol·L-1 ,H2的浓度为5mol·L-1,3min后测得NH3的浓度为0.6mol·L-1则此时间内,下列反应速率表示正确的是( )
A.v (NH3)= 0.1 mol˙L-1˙min-1B.v (N2) = 1.0 mol˙L-1˙min-1
C.v (H2) = 1.67 mol˙L-1˙min-1D.v (H2) = 0.3 mol˙L-1˙min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是( )。

A.锌是电池负极,发生还原反应
B.电子从铜电极通过电流计流向锌电极
C.盐桥中的阳离子向硫酸铜溶液中迁移
D.实验过程中取出盐桥,原电池仍继续工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是
A.AB3型的分子空间构型一定为平面三角形
B.电负性相差越大的元素间越易形成离子键
C.分子晶体中,分子间作用力越大,分子越稳定
D.用于幽门螺旋杆菌示踪的![]() 价电子排布为2s22p3
价电子排布为2s22p3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-具有还原性,含碘食盐中的碘元素主要以KIO3的形式存在,I-、I2、IO3-在一定条件下可发生如图转化关系,下列说法不正确的是
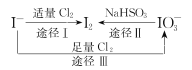
A.用淀粉-KI试纸和食醋可检验食盐是否加碘
B.由图可知氧化性的强弱顺序为Cl2>IO3->I2
C.生产等量的碘,途径I和途径II转移电子数目之比为5 :2
D.途径III反应的离子方程式:3Cl2+I-+3H2O=6Cl-+IO3-+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将100 mL 1 mol·L-1的氨水与100 mL a mol·L-1盐酸等体积混合,忽略反应放热和体积变化,下列有关推论不正确的是
A. 若混合后溶液pH=7,则c(NH4+)=c(Cl-)
B. 若a=2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. 若a=0.5,则c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. 若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应CCl4 +4Na![]() C(金刚石)+4NaCl可实现人工合成金刚石。下列关于该反应的说法错误的是( )
C(金刚石)+4NaCl可实现人工合成金刚石。下列关于该反应的说法错误的是( )
A.C(金刚石)属于原子晶体
B.该反应利用了Na的强还原性
C.CCl4和C(金刚石)中的C的杂化方式相同
D.NaCl晶体中每个Cl-周围有8个Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com