
下列能用勒夏特列原理解释的是( )
A.高温及加入催化剂都能使合成氨的反应速率加快
B.红棕色的NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡时的混合气体加压后颜色变深
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )

|
| A. | 任何化学反应都伴随着能量的变化 |
|
| B. | H2O(g)═H2O(l)该过程放出大量的热,所以该过程是化学变化 |
|
| C. | 化学反应中能量的变化都表现为热量的变化 |
|
| D. | 对于如图所示的过程,是吸收能量的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
矿泉水是人们居家旅游常用的饮料,市场上有些不法商贩为牟取暴利,用自来水(用氯气消毒)冒充矿泉水出售.为辨别真伪,可用下列的一种化学试剂来鉴别,该试剂是( )
A. 酚酞试液 B. 氯化钡溶液 C. 氢氧化钠溶液 D. 硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害.
Ⅰ. 氨气是一种重要的化工原料.
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:
CO2(g)+2NH3(g)⇌(NH2)2CO(s)+H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:则A点的逆反应速率V(逆)(CO2)<B点的正反应速率V(正)(CO2)(填“>”“=”或“<”),氨气的平衡转化率是 .
(2)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s)⇌2NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为26.该反应的化学平衡常数的表达式为K= .
Ⅱ.氮的氧化物会污染环境.
(3)采取还原法,用炭粉可将氮的氧化物还原.
已知:N2(g)+O2(g)=2NO(g)△H=+180.6kJ•mol﹣1, C(s)+O2(g)=CO2(g)△H=﹣393.5kJ•mol﹣1
写出炭粉还原一氧化氮的热化学反应方程式
(4)若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则此反应的离子反应方程式为 .若生成的CO2完全逸出,所得溶液中的离子浓度大小关系为 .

查看答案和解析>>
科目:高中化学 来源: 题型:
对可逆反应4NH3(g)+5O2(g)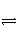
 4NO(g)+6H2O(g),下列叙述正确的是( ) A.达到化学平衡时,4v正(O2)=5v逆(NO)
4NO(g)+6H2O(g),下列叙述正确的是( ) A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成xmolNO的同时消耗xmolNH3,则反应达到平衡状态
C.化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
2000K时,反应CO(g)+ O2(g)
O2(g)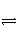
 CO2(g)的平衡常数为K,则相同温度下反应2CO2(g)
CO2(g)的平衡常数为K,则相同温度下反应2CO2(g)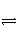
 2CO(g)+O2(g)的平衡常数K′为( )
2CO(g)+O2(g)的平衡常数K′为( )
A.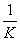 B.K2 C.
B.K2 C.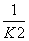 D.
D.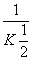
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应A(g)+B(g)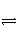
 2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。
2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。

①由T1向T2变化时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
②由T3向T4变化时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
③反应在________温度下达到平衡。
④此反应的正反应为______热反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
|
| A. | 向氧化镁中加入硫酸溶液 Mg2++SO42﹣═MgSO4 |
|
| B. | 向水中加入钠块 2Na+2H2O═2Na++2OH﹣+H2↑ |
|
| C. | 向氢氧化钡溶液中加入过量硫酸氢钠溶液 H++SO42﹣+Ba2++OH﹣═BaSO4↓+H2O |
|
| D. | 铁跟稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com