
【题目】某化学小组用图示装置制取氯气,下列说法不正确的是( )
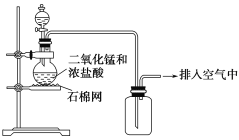
A. 该装置图中至少存在两处明显错误
B. 为了防止氯气污染空气,必须进行尾气处理
C. 在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出
D. 该实验中收集氯气的方法不正确
科目:高中化学 来源: 题型:
【题目】室温下,乙二胺(H2NCH2CH2NH2,用符号B表示)溶于水存在如下平衡:B + H2OHB+ + OH-Kb1;HB+ + H2OH2B2+ + OH-Kb2。其水溶液中的相关组分B、HB+、H2B2+的物质的量分数δ(X)随溶液pH的变化曲线如图所示[δ(X)=![]() ]。下列说法正确的是
]。下列说法正确的是
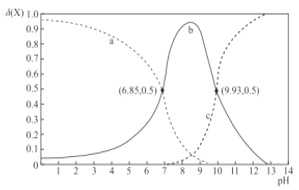
A.曲线b表示δ(H2B2+)随溶液pH的变化情况
B.等浓度的乙二胺的水溶液与盐酸等体积混合后,溶液呈酸性
C.等物质的量的[H2B]Cl2和[HB]Cl的混合溶液中,c(H2B2+)<c(HB+)
D.Kb1的数量级为10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种含高能量的正离子N5+的化合物N5AsF6,下列叙述错误的是( )
A. N5+共有34个核外电子B. N5+中氮原子以共用电子对结合
C. 化合物N5AsF6中As化合价为+1D. 化合物N5AsF6中F化合价为![]() 1
1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体粉末由NaCl、NaBr、(NH4)2CO3、Na2SO3、Na2SO4中的一种或几种组成,取该固体粉末wg进行如下实验(所加试剂均足量): ( )
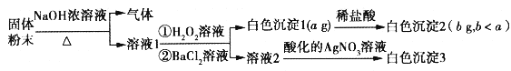
根据实验结果,下列有关说法正确的是( )
A.原固体粉末中含有NaCl
B.若溶液1中只加BaCl2溶液,则生成的白色沉淀1的质量小于或等于a g
C.原固体粉末中必含有(NH4 )2CO3、Na2SO3
D.测定出白色沉淀3的质量可以确定原固体粉末的组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向120 mL 0.005 mol·L-1 CaCl2溶液中逐滴加入0.1 mol·L-1 Na2CO3溶液,混合溶液的电导率变化曲线如图所示。已知25℃时,Ksp(CaCO3)=3.36×10-9,忽略CO32-水解。下列说法正确的是( )

A.a点对应的溶液中Ca2+开始形成沉淀,且溶液中c(Ca2+)=c(CO32-)
B.b点对应的溶液中Ca2+已完全沉淀,且存在关系:c(Na+)+c(H+)=c(Cl-)+c(OH-)
C.如图可以说明CaCO3在溶液中存在过饱和现象
D.在滴加Na2CO3溶液的过程中,混合溶液的pH先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO和NOx,减轻其对大气的污染成为科研工作的热点问题。回答下列问题:
(1)已知下列热化学方程式:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,CO2(g)+3H2(g)=CH3OH(g) +H2O(g) ΔH2=-49.0kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ·mol-1。
CH3OH(g) ΔH1,CO2(g)+3H2(g)=CH3OH(g) +H2O(g) ΔH2=-49.0kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ·mol-1。
则ΔH1=_________kJ·mol-1。
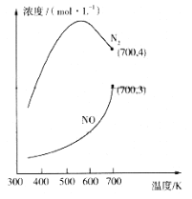
(2)用活化后的V2O5作催化剂,氨气可将NO还原成N2。
①V2O5能改变反应速率是通过改变________实现的。
②在1L的刚性密闭容器中分别充入6 mol NO、6 mol NH3和适量O2,控制不同温度,均反应tmin,测得容器中部分含氮气体浓度随温度的变化如图所示。NO浓度始终增大的原因可能是______。700K时,0~tmin内,体系中氨气的平均反应速率为______(用含t的式子表示)。
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应的热化学方程式为:2NO2(g)+4CO(g)![]() 4CO2(g) +N2(g) ΔH<0。某温度下,向10L恒容密闭容器中充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
4CO2(g) +N2(g) ΔH<0。某温度下,向10L恒容密闭容器中充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.96 | 70.7 | 69.7 | 68.75 | 68.75 |
在此温度下,反应的平衡常数Kp =________kPa-1(Kp为以分压表示的平衡常数);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡________(填“右移” “左移”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在食品加工中常作防腐剂、漂白剂、疏松剂,焦亚硫酸钠具有还原性,受潮和温度高于150℃易分解。焦亚硫酸钠与亚硫酸氢钠的转化关系是:Na2S2O5![]() NaHSO3。工业上制取原理是用纯碱与亚硫酸氢钠溶液混合而成的悬浮液吸收二氧化硫至过饱和,再从亚硫酸氢钠过饱和溶液中结晶析出焦亚硫酸钠产品。实验室模拟制取焦亚硫酸钠流程如图。
NaHSO3。工业上制取原理是用纯碱与亚硫酸氢钠溶液混合而成的悬浮液吸收二氧化硫至过饱和,再从亚硫酸氢钠过饱和溶液中结晶析出焦亚硫酸钠产品。实验室模拟制取焦亚硫酸钠流程如图。

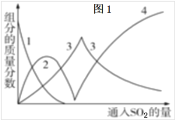
(1)Ⅰ中用Na2CO3溶液吸收SO2,随着SO2的持续通入,溶液中各组分的质量分数变化如图1所示。图中线2表示的组分是___(填化学式,下同)。Ⅰ中产物是___。
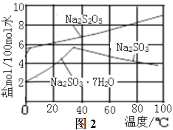
(2)实验时采用80℃的水浴加热,反应后的体系中有少量亚硫酸钠析出,根据图2溶解度曲线,获得较纯的无水Na2S2O5的方法是___。

(3)图3为真空干燥Na2S2O5晶体的装置,真空干燥的目的是___。
(4)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法(杂质不与碘反应)。
已知:S2O![]() +2I2+3H2O=2SO
+2I2+3H2O=2SO![]() +4I-+6H+;2S2O
+4I-+6H+;2S2O![]() +I2=S4O
+I2=S4O![]() +2I-。
+2I-。
实验步骤如下:
①称取0.2000g产品放入碘量瓶中。
②加入40.00mL0.1000mol·L-1的标准碘溶液,在暗处放置5min,再加入适量冰醋酸及蒸馏水。
③用0.2000mol·L-1的标准Na2S2O3溶液滴定剩余的碘至接近终点。
④加入1~2mL淀粉溶液。
⑤继续用标准Na2S2O3溶液滴定至___,记录滴定所消耗的体积。
⑥重复步骤①~⑤;平均消耗标准Na2S2O3溶液20.00mL。则产品中焦亚硫酸钠的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,一元弱碱甲胺(CH3NH2)的电离常数Kb≈4.0×10-4,lg5≈0.7。电解质溶液的电导率与离子浓度有关,电导率越大,溶液的导电能力越强。常温下,用0.02mol·L-1盐酸分别滴定20.00mL浓度均为0.02mol·L-1的NaOH溶液和CH3NH2溶液,利用传感器测得滴定过程中溶液的电导率如图所示。下列推断正确的是( )
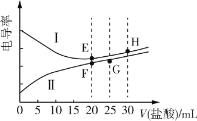
A.曲线Ⅰ代表NaOH的滴定曲线,H点对应的溶液中不存在电离平衡
B.G点对应的溶液中:c(Cl-)>c(H+)>c(CH3NH![]() )>c(OH-)
)>c(OH-)
C.常温下,E、F点对应的溶液中水电离的c(H+)水·c(OH-)水=1.0×10-14
D.常温下,F点对应的溶液的pH≈6.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明,美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如图所示:
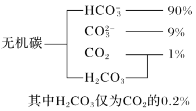
用离子方程式表示海水呈弱碱性的原因__。已知春季海水pH=8.1,预测夏季海水碱性将会__(填“增强”或“减弱”)
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是__(填字母)。
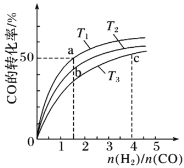
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
D.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
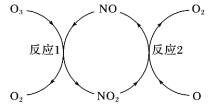
①NO的作用是__。
②已知:
O3(g)+O(g)=2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为__。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随![]() 的变化曲线如图。
的变化曲线如图。
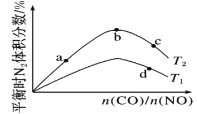
①b点时,平衡体系中C、N原子个数之比接近___。
②a、b、c三点CO的转化率从大到小的顺序为__;a、c、d三点的平衡常数从大到小的顺序为___。
③若![]() =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为___。
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com