
【题目】室温下,乙二胺(H2NCH2CH2NH2,用符号B表示)溶于水存在如下平衡:B + H2OHB+ + OH-Kb1;HB+ + H2OH2B2+ + OH-Kb2。其水溶液中的相关组分B、HB+、H2B2+的物质的量分数δ(X)随溶液pH的变化曲线如图所示[δ(X)=![]() ]。下列说法正确的是
]。下列说法正确的是
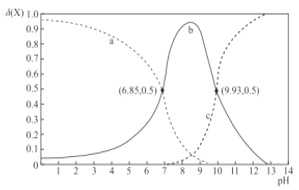
A.曲线b表示δ(H2B2+)随溶液pH的变化情况
B.等浓度的乙二胺的水溶液与盐酸等体积混合后,溶液呈酸性
C.等物质的量的[H2B]Cl2和[HB]Cl的混合溶液中,c(H2B2+)<c(HB+)
D.Kb1的数量级为10-4
【答案】C
【解析】
由图可知,曲线a在强酸性条件下含量最高,说明该曲线是H2B2+的物质的量分数随溶液pH的变化曲线;曲线b在强酸性或强碱性条件下含量极低,说明该曲线是HB+的物质的量分数随溶液pH的变化曲线;则曲线c表示B的物质的量分数随溶液pH的变化曲线;由a、b曲线交点可以计算Kb2=![]() =10-7.15,由b、c曲线交点可以计算Kb1=
=10-7.15,由b、c曲线交点可以计算Kb1=![]() =10-4.07,据此分析。
=10-4.07,据此分析。
A.由上述分析,曲线b是HB+的物质的量分数随溶液pH的变化曲线,A错误;
B.由图可知,Kb1=10-4.07,Kb2=10-7.15,等浓度的乙二胺的水溶液与盐酸等体积混合后所得溶液中的溶质为[HB]Cl,Kh(HB+)=![]() =10-9.93,则HB+的电离程度大于其水解程度,溶液呈碱性,B错误;
=10-9.93,则HB+的电离程度大于其水解程度,溶液呈碱性,B错误;
C.等物质的量的[H2B]Cl2和[HB]Cl的混合溶液中,Kh(H2B2+)=![]() =10-6.85>Kb2,则混合溶液中c(H2B2+)<c(HB+),C正确;
=10-6.85>Kb2,则混合溶液中c(H2B2+)<c(HB+),C正确;
D.由分析可知Kb1=10-4.07,则Kb1的数量级为10-5,D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】电厂烟气脱氮的主反应为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H1,副反应为:2NH3(g)+8NO(g)
5N2(g)+6H2O(g) △H1,副反应为:2NH3(g)+8NO(g)![]() 5N2O(g)+3H2O(g) △H2。平衡混合气中N2与N2O含量与温度的关系如图所示。下列说法错误的是( )
5N2O(g)+3H2O(g) △H2。平衡混合气中N2与N2O含量与温度的关系如图所示。下列说法错误的是( )
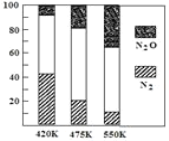
A.△H1<0 △H2>0
B.选择合适的催化剂,升高温度等措施可以加快脱氮反应速率
C.理论上较高的温度和较低压强有利于生成无公害气体
D.反应过程中,采取不断分离出N2(g)有利于主反应的进行,提高反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对SO2使溶液褪色的机理进行探究。
I.SO2气体的制备和性质初探
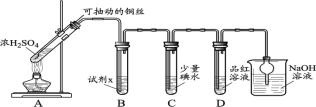
(1)装置A中发生反应的化学方程式____________。
(2)装置B中的试剂x是____________。
(3)小组同学观察到C、D中溶液均褪色,通过检验C溶液中有SO42-,得出C中溶液褪色的原因是____________。
II.小组同学通过实验继续对D中品红溶液褪色进行探究。
(4)探究使品红褪色的主要主要微粒(分别取2 mL试剂a,滴加2滴品红溶液)
装置 | 序号 | 试剂a | 实验现象 |
| i | 0.1 mol/L SO2溶液(pH=2) | 红色逐渐变浅,之后完全褪色 |
ii | 0.1 mol/L NaHSO3溶液(pH=5 ) | 红色立即变浅,之后完全褪色 | |
iii | 0.1 mol/L Na2SO3溶液( pH=10) | 红色立即褪色 | |
iv | pH=2H2SO4溶液 | 红色无明显变化 | |
v | 试剂a | 红色无明显变化 |
①实验 iii中Na2SO3溶液显碱性的原因_____________(结合化学用语分析解释)。
②对比实验iii 和v,可以排除在该实验条件下OH-对品红褪色的影响,则试剂a可能
是__________溶液。
查阅资料:品红与SO2水溶液、NaHSO3溶液、Na2SO3溶液反应前后物质如下:
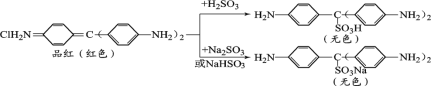
③通过上述实验探究并结合资料,小组同学得出结论:一是使品红溶液褪色的主要微粒是________;二是品红溶液中颜色变化主要与其分子中的________结构有关。
(5)验证SO2使品红褪色反应的可逆性
①甲同学加热实验i褪色后的溶液,产生刺激性气味气体,红色恢复,从化学平衡移动角度解释红色恢复的原因__________。
②乙同学向实验i褪色后的溶液中滴入Ba(OH)2溶液至pH=10,生成白色沉淀,溶液变红。写出生成白色沉淀的离子方程式___________。
③丙同学利用SO2的还原性,运用本题所用试剂,设计了如下实验,证实了SO2使品红褪色反应的可逆:则试剂Y是__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组使用下图装置制取并收集干燥、纯净的氯气,请回答问题:
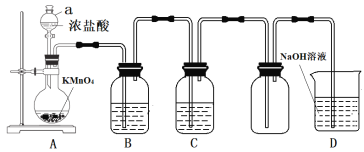
(1)A装置中仪器a的名称是__________,KMnO4的作用_____________________
(2)C装置盛放的试剂是_______________,其作用是____________________
(3)写出D装置中反应的离子方程式__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为VL的密闭容器中进行反应:aN(g)bM(g)(a≠b),M、N的物质的量随时间的变化曲线如图所示:
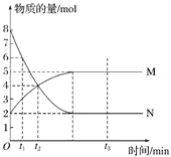
下列叙述中能说明上述反应达到平衡状态的是___。
A.反应中M与N的物质的量之比为1∶1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗amolN,同时生成bmolM
E.混合气体的压强不随时间的变化而变化
F.N的转化率达到最大,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某三元羧酸 H3A 在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向 10 mL 0.01 mol·L1 的 H3A 溶液中滴入 0.01 mol·L1 的 NaOH 溶液,H3A、H2A、HA2、A3的物质的量分数与溶液的 pH 的关系如 图所示。下列说法错误的是( )
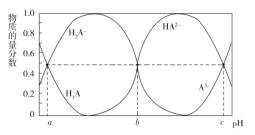
A.该温度下,H3A 的电离常数 Ka1=10a
B.若 b=7,加入 20 mL NaOH 溶液时,溶液的 pH<7
C.NaOH 溶液的体积为 30 mL 时,溶液中:c(OH)=3c(H3A)+2c(H2A)+c(HA2)+c(H+)
D.反应 2H2A![]() H3A+HA2在该温度下的平衡常数K=10a-b
H3A+HA2在该温度下的平衡常数K=10a-b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1799年由英国化学家汉弗莱·戴维发现一氧化二氮(N2O)气体具有轻微的麻醉作用,而且对心脏、肺等器官无伤害,后被广泛应用于医学手术中。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为 ___。
(2)已知反应2N2O(g)=2N2(g)+O2(g)的ΔH=–163kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为______kJ。
在的一能定量温为度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
![]()
①在0~20min时段,反应速率v(N2O)为 ___mol·L-1·min-1。
②若N2O起始浓度c0为0.150mol/L ,则反应至30min时N2O的转化率α=___。
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1 ___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p= ___(用p0表示)。

(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) = 2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时NO分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___(填标号)。
A.温度升高,k值增大 B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大 D.I2浓度与N2O分解速率无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用图示装置制取氯气,下列说法不正确的是( )
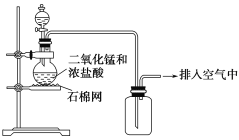
A. 该装置图中至少存在两处明显错误
B. 为了防止氯气污染空气,必须进行尾气处理
C. 在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出
D. 该实验中收集氯气的方法不正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com