
分析 (1)依据m=CVM计算需要溶质的质量;
(2)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器,依据配制溶液体积选择需要容量瓶规格;
(3)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,据此排序;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制480mL0.2mol/L的NaOH溶液,需要选择500mL容量瓶,实际配制500mL溶液,需要氢氧化钠的质量m=0.2mol/L×40g/mol××0.5L=4.0g;
故答案为:4.0;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,配制480mL0.2mol/L的NaOH溶液,应选择500mL容量瓶,所以还缺少的玻璃仪器:500ml容量瓶;
故答案为:500ml容量瓶;
(3)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,所以正确的顺序为:D H B F A E C G;
故答案为:D H B F A E C G;
(4)①加蒸馏水不慎超过了刻度,导致溶液体积偏大,溶液浓度偏低;
②容量瓶不干燥,有一定的水分,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变;
③仰视观察到液面刚好到达刻度线,导致溶液体积偏大,溶液浓度偏低;
故答案为:①偏低 ②无影响 ③偏低;
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和操作步骤是解题关键,注意误差分析的方法,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 外界条件相同时,放热反应的速率一定大于吸热反应的速率 | |
| B. | 化学反应中的能量变化可表现为热量的变化 | |
| C. | 反应物的总能量高于生成物的总能量时,发生放热反应 | |
| D. | CaO+H2O═Ca(OH)2反应过程中,旧键断裂吸收的能量小于新键形成释放的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该体系中HF与CaCl2反应产生沉淀 | |
| B. | 25℃时,CaF2比CaCO3的溶解度更小 | |
| C. | 25℃时,0.1 mol•L-1 HF溶液中pH<1 | |
| D. | Ksp(CaF2)随温度和浓度的变化而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓 度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
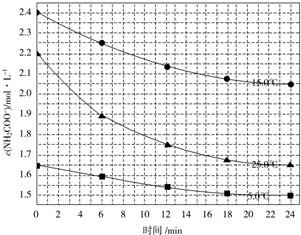
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸见光分解:4HNO3$\frac{\underline{\;光照\;}}{\;}$4NO2↑+O2↑+2H2O | |
| B. | 往NaOH溶液中通入过量二氧化硫:2NaOH+SO2═Na2SO3+H2O | |
| C. | SO2气体通入BaCl2溶液中产生白色沉淀:SO2+BaCl2+H2O═BaSO3↓+2HCl | |
| D. | Fe与稀H2SO4反应的化学方程式为:2Fe+3H2SO4═Fe2(SO4)3+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2 和Na2O | B. | MgCl2 和Na2S | C. | CaO和CO2 | D. | HCl 和NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com