
【题目】纯碱是一种重要的化工原料,广泛应用于玻璃、造纸、纺织和洗涤剂的生产。
(1)起初,人们从盐碱地和盐湖中获得纯碱,但远远不能满足工业发展的需要,纯碱的化学式为________。
1791年,“路布兰制碱法”取得专利。该方法以硫酸、氯化钠、木炭、白垩石(主要成分为碳酸钙)为原料,但在20世纪20年代后被淘汰,因为生产过程中释放出HCl气体,该气体遇空气中的水蒸气易形成酸雾,腐蚀金属设备。
(2)1861年,“索尔维制碱法”问世,该方法是在用氯化钠溶液吸收两种工业废气时意外发现的,反应后生成碳酸氢钠和氯化铵(NH4Cl),再加热碳酸氢钠即可制得纯碱,氯化钠溶液吸收的两种气体为________(填字母)。
A.Cl2 B.NH3 C.SO2 D.CO2
(3)“侯氏制碱法”由我国化学工程专家侯德榜先生于1943年创立,是对“索尔维制碱法”的改进,将氨碱法制取碳酸钠与合成氨联合起来,大大提高了食盐的利用率,缩短了生产流程,减少了对环境的污染,至今仍为全世界广泛采用。
用如图所示装置可以模拟“加热碳酸氢钠制得纯碱”的过程。
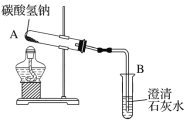
当观察到B中出现浑浊时,停止加热,A中发生反应的化学方程式为____________。
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】已知非金属元素A、B、C、D、E均属于短周期元素,其原子序数依次增大,A元素原子形成的离子核外电子数为零,B原子的最外层电子数是内层电子数的2倍,通常状况下E的单质是黄色晶体,不溶于水,易溶于二硫化碳,D与E在同一主族,C、D在周期表中处于相邻的位置,请回答下列问题:
(1)B元素的名称是___,E的阴离子结构示意图是___。
(2)A元素与元素周期表中非金属性最强的元素形成化合物M,M溶液常被用来刻蚀玻璃,刻蚀玻璃的化学方程式为____。
(3)元素C的最高价氧化物对应水化物与其气态氢化物反应生成化合物Z,该反应的离子方程式为____,形成化合物Z的阳离子在实验室中如何检验?简述操作步骤。____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)利用铬铁矿(FeOCr2O3)冶炼制取金属铬的工艺流程如图所示:
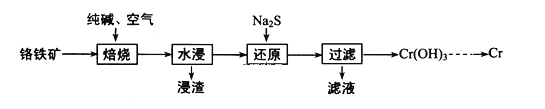
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___。
②浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则“还原”操作中发生反应的离子方程式为___。
(2)已知25℃时Cr3+恰好完全沉淀时溶液pH为5,(Cr3+浓度降至10-5molL-1可认为完全沉淀)则Cr(OH)3的溶度积常数Ksp=___。
(3)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+![]() Cr2O72-+H2O)。
Cr2O72-+H2O)。
①电极b连接电源的__极(填“正”或“负”),b极发生的电极反应:___。
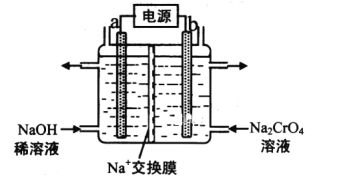
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则理论上生成重铬酸钠的物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是
A. 电解熔融NaCl制取金属钠的反应中,钠离子被还原,氯离子被氧化
B. 湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C. 用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移9 mol e
D. 铝热法还原铁的反应中,放出的热量能使铁熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3是常见的一种盐,工业上可作防腐剂、去氯剂和还原剂。
(1)Na2SO3固体隔绝空气加强热,反应后的固体中含有S2-。反应的化学方程式为________________;若有0.5molNa2SO3参加反应,则电子转移个数为_____________________。
(2)将0.1mol/L Na2SO3溶液先升温再降温,测定温度变化过程中的pH,数据如下:
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
①时刻Na2SO3溶液中水的电离程度_______同温下纯水中水的电离程度(填)“>”、“<”或“=”);应用平衡原理解释该原因_________________________________。④的pH略小于①,是由于______________________。设计一个简单实验来证明_____________________。
(3)将Na2SO3溶液中所有离子浓度由大到小排列_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据),根据下图回答下列问题:

(1)PCl5分解生成PCl3和Cl2的热化学方程式__________________________;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8 mol PCl5,反应达到平衡时还剩余0.6 mol PCl5,其分解率α1等于____________;若反应温度由T1升高到T2,平衡时PCl5的分解率α2,α2____________α1(填“大于”、“小于”或“等于”)。
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是______________________________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A.23gNa与氧气充分反应,生成Na2O和Na2O2的混合物,转移的电子数为大于NA小于2NA
B.0.5mol甲醇中含有的共价键数为2.5NA
C.标准状况下,0.25molHF的体积为5.6L
D.0.2mol/L的Na2SO4溶液中含Na+ 数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( )

离子交换膜
A.电极A为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.饱和NaCl从a处进,NaOH溶液从d处出
D.OH-迁移的数量等于导线上通过电子的数量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com