
【题目】某实验小组设计了如图装置对焦炭还原二氧化硅的气体产物的成分进行探究。
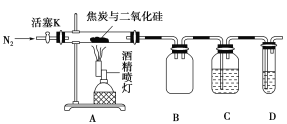
已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO+PdCl2+H2O=CO2+2HCl+Pd↓(产生黑色金属钯粉末,使溶液变浑浊)。
(1)实验时要通入足够长时间的N2,其原因是________。
(2)装置B的作用是__________。
(3)装置C、D中所盛试剂分别为______、_______,若装置C、D中溶液均变浑浊,且经检测两气体产物的物质的量相等,则该反应的化学方程式为________。
(4)该装置的缺点是________。
(5)资料表明,上述反应在焦炭过量时会生成副产物SiC。取18 g SiO2和8.4 g焦炭充分反应后收集到标准状况下的气体13.44 L,假定气体产物只有CO,固体产物只有Si和SiC,则Si和SiC的物质的量之比为______。
【答案】将装置中的空气排尽,避免空气中的氧气、二氧化碳、水蒸气对实验产生干扰 作安全瓶,防止倒吸 澄清石灰水 PdCl2溶液 3SiO2+4C![]() 2CO2↑+2CO↑+3Si 缺少尾气处理装置 2∶1
2CO2↑+2CO↑+3Si 缺少尾气处理装置 2∶1
【解析】
(1)碳与二氧化硅反应要在高温下进行,而高温下碳与空气中氧气反应,所以实验时要将装置中的空气排尽;
(2)根据装置图可知,B装置可以作安全瓶,防止倒吸;
(3)根据元素守恒,碳与二氧化硅反应可能生成一氧化碳也可能生成二氧化碳,所以C装置用来检验有没有二氧化碳,D装置用来检验一氧化碳;若装置C、D中溶液均变浑浊,说明既有二氧化碳又有一氧化碳,检测两气体产物的物质的量相等,根据元素守恒可写出化学方程式;
(4)一氧化碳有毒,有能排放到空气中,而该装置没有尾气吸收装置;
(5)取18g Si02物质的量=![]() =0.3mol,8.4g焦炭物质的量=
=0.3mol,8.4g焦炭物质的量=![]() =0.7mol,充分反应后收集到标准状况下的气体13.44L,物质的量=
=0.7mol,充分反应后收集到标准状况下的气体13.44L,物质的量=![]() =0.6mol,假定气体产物只有CO,固体产物只有Si和SiC,SiO2+2C=2CO+Si,Si+C=SiC,依据化学方程式计算;
=0.6mol,假定气体产物只有CO,固体产物只有Si和SiC,SiO2+2C=2CO+Si,Si+C=SiC,依据化学方程式计算;
(1)碳与二氧化硅反应要在高温下进行,而高温下碳与空气中氧气反应,所以实验时要将装置中的空气排尽,所以实验时要通人足够长时间的N2,
故答案为:要用氮气将装置中的空气排尽,避免空气中的氧气、二氧化碳、水蒸气对实验产生干扰;
(2)根据装置图可知,B装置可以作安全瓶,防止倒吸
故答案为:作安全瓶,防止倒吸;
(3)根据元素守恒,碳与二氧化硅反应可能生成一氧化碳也可能生成二氧化碳,所以C装置用来检验有没有二氧化碳,D装置用来检验一氧化碳,所以置C、D中所盛试剂分别为澄清石灰水、PdCl2溶液;若装置C、D中溶液均变浑浊,说明既有二氧化碳又有一氧化碳,检测两气体产物的物质的量相等,根据元素守恒可知化学方程式为3SiO2+4C![]() 2CO2+2CO+3Si;
2CO2+2CO+3Si;
故答案为:澄清石灰水;PdCl2溶液;3SiO2+4C![]() 2CO2+2CO+3Si;
2CO2+2CO+3Si;
(4)一氧化碳有毒,有能排放到空气中,而该装置没有尾气吸收装置将CO吸收,故答案为:没有尾气吸收装置将CO吸收;
(5)取18g Si02物质的量=![]() =0.3mol,8.4g焦炭物质的量=
=0.3mol,8.4g焦炭物质的量=![]() =0.7mol,充分反应后收集到标准状况下的气体13.44L,物质的量=
=0.7mol,充分反应后收集到标准状况下的气体13.44L,物质的量=![]() =0.6mol,假定气体产物只有CO,固体产物只有Si和SiC,
=0.6mol,假定气体产物只有CO,固体产物只有Si和SiC,
SiO2 + 2C = 2CO + Si,
0.3mol 0.6mol 0.6mol0.3mol
Si+ C= SiC,
1 1 1
0.1mol 0.1mol 0.1mol
得到Si和SiC的物质的量之比为0.2mol:0.1mol=2:1;
故答案为:2:1;


科目:高中化学 来源: 题型:
【题目】制备氮化镁的装置如图所示。实验时在不锈钢舟内加入镁粉,通氮气15min,升温至1073K,加热半小时,冷却至室温,停止通氮气。下列说法正确的是( )
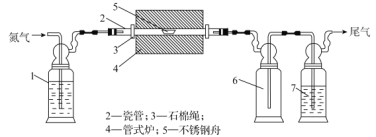
A.1中的试剂是饱和食盐水,便于观察气泡,调节气流速度
B.6的作用是缓冲加热后未反应的氮气,7的作用是防止空气中的水分进入装置
C.氮化镁是共价化合物,露置于空气中有刺激性气味的气体产生
D.实验中氮气是反应物,仅起到氧化镁粉的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列说法正确的是
2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列说法正确的是
①用A表示的反应速率是0.4mol·L-1·min-1
②在2min末时,反应物B的反应速率是0.3mol·L-1·min-1
③在这2min内用C表示的平均速率为0.2mol·L-1·min-1
④在2min时,B、C、D的浓度比一定为3∶2∶1
⑤若D的起始浓度为0.1mol·L-1,则2 min时D的浓度为0.3mol·L-1
A.①②③B.②③⑤C.④⑤D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱的纯度,试根据实验回答:
(1)称取4.1g烧碱样品。将样品配成250mL待测液,需要的主要玻璃仪器除烧杯、玻璃棒外还需__________________ 、______________________。
(2)取10.00mL待测液,用___________________量取。
(3)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶,直到看到_________即可判断达到滴定终点。
(4)根据下列数据,计算待测烧碱溶液的浓度为:___________(结果保留四位有效数字)。(假设烧碱中不含有与酸反应的杂质)
滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)滴定过程,下列情况会使测定结果偏高的是____________________(填序号)。
①酸式滴定管用水洗后便装液体进行滴定;
②碱式滴定管水洗后,就用来量取待测液;
③锥形瓶用蒸馏水洗涤后,又用待测液润洗;
④滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下;
⑤盐酸在滴定时溅出锥形瓶外;
⑥滴加盐酸,溶液颜色褪去但不足半分钟又恢复红色;
⑦滴定前,酸式滴定管有气泡,滴定后消失;
⑧记录起始体积时,仰视读数,终点时俯视。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向密闭容器中充入30 mL CO和20 mL水蒸气,使其反应;当反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)达到平衡时,水蒸气的体积分数与H2的体积分数相等,则下列叙述错误的是
CO2(g)+H2(g)达到平衡时,水蒸气的体积分数与H2的体积分数相等,则下列叙述错误的是
A. 平衡后CO的体积分数为40%
B. 平衡后CO的转化率为25%
C. 平衡后水的转化率为50%
D. 平衡后混合气体的平均相对分子质量为24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图
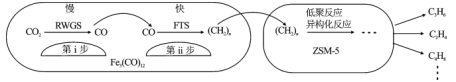
下列说法正确的是
A.第i步反应为CO2+H2=CO+H2O
B.第i步反应的活化能低于第ii步
C.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯的△H减小
D.添加不同助剂后,反应的平衡常数各不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1 L 0.1 mol/L的醋酸溶液用蒸馏水稀释到10 L,下列叙述正确的是( )
A. c(CH3COOH)变为原来的1/10
B. c(H+)变为原来的![]()
C. c(CH3COO-)/c(CH3COOH)的比值增大
D. 溶液的导电性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺(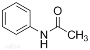 )在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(
)在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(![]() )和乙酸酐(
)和乙酸酐(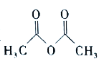 )反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为114℃,易溶于有机溶剂。在水中的溶解度如下。
)反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为114℃,易溶于有机溶剂。在水中的溶解度如下。
温度/℃ | 20 | 25 | 50 | 80 | 100 |
溶解度/(g/100g水) | 0.46 | 0.56 | 0.84 | 3.45 | 5.5 |
实验室制备乙酰苯胺的步骤如下(部分装置省略):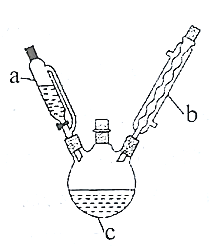
Ⅰ.粗乙酰苯胺的制备。将7mL(0.075mol)过量乙酸酐放入三颈烧瓶c中,在a中放入5mL(0.055mol)新制得的苯胺。将苯胺在室温下逐滴滴加到三颈烧瓶中。苯胺滴加完毕,在石棉网上用小火加热回流30min,使之充分反应。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有100mL冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用__洗涤晶体2-3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。
Ⅱ.乙酰苯胺的提纯。将上述制得的粗乙酰苯胺固体移入250mL烧杯中,加入100mL热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸5min,趁热过滤。待滤液冷却至室温,有晶体析出,__、洗涤、干燥后称量产品为5.40g。
回答下列问题:
(1)仪器b的名称是__。
(2)步骤I中,减压过滤的优点是过滤速度快,同时所得固体更干燥,用滤液而不用蒸馏水冲洗烧杯的原因是__;洗涤晶体最好选用__(填字母)。
A.乙醇 B.CCl4 C.冷水 D.乙醚
(3)步骤Ⅱ中,粗乙酰苯胺溶解后,补加少量蒸馏水的目的是__。
(4)步骤Ⅱ中,洗涤干燥前的操作是___。上述提纯乙酰苯胺的方法叫__。
(5)乙酰苯胺的产率为___。(计算结果保留3位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com