


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 事实 | 解释或结论 | |||||
| 1 | 常温下铜、铝均不溶于浓硫酸 | 常温下铜、铝与浓硫酸均不反应 | ||||
| 2 | 测定同浓度的Na2CO3溶液的pH小于Na2SiO2溶液的pH | 水解程度:CO
| ||||
| 3 | 氯水点到蓝色石蕊试纸先变红后褪色 | 氯水中含有H+有酸性、Cl2有漂白性 | ||||
| ④ | 向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| A.①②③④ | B.②③ | C.①②③ | D.①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
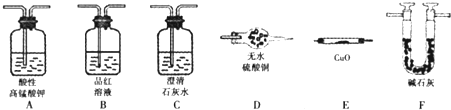
科目:高中化学 来源:不详 题型:单选题
A.
| B.
| C.
| D.
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| a-b |
| 3 |
| b-a |
| 4 |
| b |
| 22.4 |
| A.只有①正确 | B.只有②正确 |
| C.①②③都不正确 | D.①②③都正确 |
查看答案和解析>>
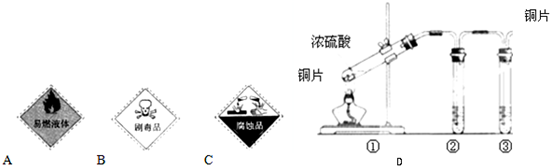
科目:高中化学 来源:不详 题型:单选题

| A.C的成分是气体E与二氧化碳的混和气体 |
| B.浓热的D溶液能把碳单质氧化为二氧化碳 |
| C.气体E遇空气会被氧化成红棕色的气体 |
| D.溶液G是蓝色的硫酸铜溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com