
| A、SiO2 |
| B、Na2O |
| C、Ca(OH)2 |
| D、H2SO4 |


科目:高中化学 来源: 题型:
| A、乙醇、乙烷和乙酸都可以与钠反应生成氢气 |
| B、乙醇可以被酸性重铬酸钾溶液直接氧化为乙酸 |
| C、乙烯使溴水和酸性高锰酸钾溶液褪色的反应均属于加成反应 |
| D、汽油、柴油和植物油都是碳氢化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
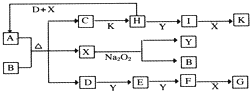
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,0.1mol/L的醋酸中,c(H+)=0.1mol/L | ||
| B、在稀醋酸溶液中加入少量醋酸钠固体,会促进醋酸的电离 | ||
| C、在稀氨水中通入氨气,所得溶液的pH减小 | ||
D、向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 |
| B、若金属全部溶解,则溶液中一定含有Fe3+ |
| C、溶液中可能只有Cu2+ |
| D、溶液中可能只有Fe2+ 和Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用标准氢氧化钠溶液滴定待测醋酸,选用酚酞作指示剂 |
| B、配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再加水稀释到所需的浓度 |
| C、测定某溶液的pH时,用pH试纸蘸取待测液,然后和比色卡对比得出pH |
| D、将淀粉溶液加到饱和食盐水中,检验食盐是否是加碘食盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com