胆矾晶体是硫酸铜的结晶水合物,其化学式为CuSO
4?5H
2O.在加热情况下,按温度不同,胆矾晶体会历经一系列的变化,得到不同组成的固体.(第(1)(2)问用小数表示)
(1)称取0.10g含有杂质的胆矾试样于锥形瓶中,加入0.10mol/L氢氧化钠溶液28.00mL,反应完全后,过量的氢氧化钠用0.10mol/L硫酸滴定到终点,消耗硫酸10.08mL,则试样中胆矾的质量分数为
(已知:CuSO
4+2NaOH→Cu(OH)
2+Na
2SO
4;试样中杂质不与酸碱反应)
(2)将1.250g 纯净的胆矾晶体置于坩埚中加热一段时间,测得剩余固体质量为0.960g.剩余固体中结晶水的质量分数为
(保留三位小数).
(3)将无水硫酸铜加热至650℃以上,可得到黑色的氧化铜与三氧化硫、二氧化硫和氧气的混合气体.现将9.600g无水硫酸铜充分加热分解为氧化铜,将生成的气体通过足量的吸收剂(碱石灰),吸收剂增重4.416g.则最终吸收剂中硫酸盐与亚硫酸盐的物质的量之比为
(4)取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960mL的NO
2气体和672mL N
2O
4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02g.则x等于
.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案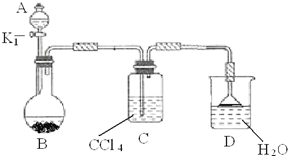 以下为苯的取代反应的探究实验.
以下为苯的取代反应的探究实验. 根据废水中所含有害物质的不同,工业上有多种废水的处理方法.
根据废水中所含有害物质的不同,工业上有多种废水的处理方法.