
【题目】下列物质的水溶液能使蓝色石蕊试纸变红的是
A.NH3B.Na2CO3C.NaHSO4D.NaOH
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
【题目】下列物质进行一氯取代反应,产物只有两种的是
A. (CH3)2CHCH2CH2CH3B. (CH3CH2)2CHCH3
C. (CH3)2CHCH(CH3)2D. (CH3)3CCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铜与6molL-1硝酸反应的气态产物中是否含NO2,进行如下实验。

已知:FeSO4+NO ![]() [Fe(NO)]SO4(棕色),该反应较缓慢,待生成一定量2+时突显明显棕色。
[Fe(NO)]SO4(棕色),该反应较缓慢,待生成一定量2+时突显明显棕色。
(1)实验前需检验装置的气密性,简述操作_____________________________________。
(2)仪器a的名称____________
(3)实验开始时先将Y形试管向盛有块状固体b的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是_________;
(4)证明有NO2的实验现象___________________________________
(5)装置C的作用________,反应离子方程式____________。
(6)测定化学试剂绿矾(FeSO4·7H2O)纯度的方法:称取绿矾3.000g置于锥形瓶中,加入100mL蒸馏水,加入10mLH2SO4和5mLH3PO4,用0.1000molL-1KMnO4溶液滴定至终点,消耗KMnO4溶液20.00mL。KMnO4溶液盛放在棕色_____式(填“酸”或“碱”)滴定管中,列式计算绿矾的纯度_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)用单线桥标出①中电子转移的方向和数目_____;
(2)写出②的离子化学方程式____;
(3)Cl2、SO2和KMnO4的氧化性由强到弱的顺序为____;
(4)反应②中氯化氢表现出的性质是____。
a.还原性 b.酸性 c.氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32-水解
C. 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理
D. 配制FeCl3溶液时加入少量的盐酸,抑制Fe3+水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,Ksp(BaSO4)=1×10-10 mol2·L-2,Ksp(BaCO3)=5.1×10-9 mol2·L-2。在该温度下,下列说法不正确的是( )
A. 因为Ksp(BaCO3)>Ksp(BaSO4),所以BaSO4比BaCO3溶解度更小
B. 若误饮c(Ba2+)=1.0×10-5mol·L-1的溶液时,会引起Ba2+中毒
C. 向同浓度Na2SO4和Na2CO3的混合液中滴加BaCl2溶液,BaSO4先析出
D. 在BaSO4的饱和溶液液中,c(SO42-)=1.0×10-5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol/L的NaOH溶液,乙为0.1 mol/L的HCl溶液,丙为0.1 mol/L的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=__________;
(2)丙溶液中存在电离平衡为_____________、______________(用电离方程式表示);
(3)某同学用甲溶液分别滴定20.00 mL乙溶液和 20.00 mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
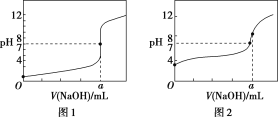
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”);
②a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向0.1moLH2S溶液中通入HCl气体或加入NaOH固体,测得c(S2-)与溶液pH的关系如图(忽略溶液体积的变化及H2S的挥发)。已知常温下,H2S在水中的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。下列说法错误的是

A. 当溶液中c(S2-)=1.4×10-19mol/L时,溶液中由水电离出的H+浓度为1.0×10-13mo/L
B. 0.1mo/LNa2S溶液中离子浓度之间的关系为:c(Na+)>c(HS-)+2c(S2-)
C. 常温下,0.1 mol/L NaHS溶液的pH<7
D. 当pH=13时,溶液中的c(H2S)+c(HS-)=0.043mo/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com