

分析 碳酸钙、碳酸镁与稀硝酸反应生成硝硝酸钙、硝酸镁与二氧化碳,碳酸亚铁与稀硝酸反应生成硝酸铁、二氧化碳、NO,溶液中加入浓氨水,镁离子、铁离子转化为氢氧化镁、氢氧化铁沉淀,过滤除去,滤液中加入碳酸铵将硝酸钙转化为碳酸钙,过滤分离得到碳酸钙,再与盐酸反应生成氯化钙,在加入过氧化氢、氨气得到反应得到CaO2,溶液冷却结晶得到CaO2•8H2O,副产品中含有氯化铵,
(1)反应①中只有FeCO3与硝酸反应是氧化还原反应生成硝酸铁、一氧化氮、二氧化碳和水;
(2)加入氨水使Mg2+、Fe3+沉淀完全生成氢氧化镁沉淀、氢氧化铁沉淀;
(3)H2O2受热易分解,采用冰水控制温度在0℃左右,防止其分解,提高利用率,同时温度低能降低CaO2•8H2O溶解度,提高产率;
(4)①根据滴定结束前溶液为蓝色,滴定结束是溶液由蓝色变成无色分析;根据电子守恒及化学反应方程式找出过氧化钙与硫代硫酸钠反应的关系式,再根据题中数据计算出样品中过氧化钙的质量分数;
②根据空气中的氧气能够氧化碘离子,使碘单质的量增加,消耗的硫代硫酸钠增加分析.
解答 解:碳酸钙、碳酸镁与稀硝酸反应生成硝硝酸钙、硝酸镁与二氧化碳,碳酸亚铁与稀硝酸反应生成硝酸铁、二氧化碳、NO,溶液中加入浓氨水,镁离子、铁离子转化为氢氧化镁、氢氧化铁沉淀,过滤除去,滤液中加入碳酸铵将硝酸钙转化为碳酸钙,过滤分离得到碳酸钙,再与盐酸反应生成氯化钙,在加入过氧化氢、氨气得到反应得到CaO2,溶液冷却结晶得到CaO2•8H2O,副产品中含有氯化铵,
(1)反应①中只有FeCO3与硝酸反应是氧化还原反应生成硝酸铁、一氧化氮、二氧化碳和水,反应方程式为:3FeCO3+10H++NO3-=3Fe3++NO↑+3CO2↑+5H2O,
故答案为:3FeCO3+10H++NO3-=3Fe3++NO↑+3CO2↑+5H2O;
(2)加入氨水使Mg2+、Fe3+沉淀完全,反应的离子方程式为:Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+,Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,
故答案为:Mg2+和Fe3+沉淀完全;
(3)H2O2受热易分解,采用冰水控制温度在0℃左右,防止其分解,提高利用率,同时温度低能降低CaO2•8H2O溶解度,提高产率,
故答案为:防止H2O2分解,提高其利用率;降低CaO2•8H2O溶解度,提高产率;
(4)①在滴定结束之前,溶液的淀粉与碘单质显示蓝色,当碘单质反应完全后,溶液变成无色,所以达到终点现象为:当滴入最后一滴标准溶液时溶液由蓝色变为无色(或溶液褪色),且半分钟不变色,
过氧化钙氧化碘化钾生成的碘单质,用硫代硫酸钠滴定时,消耗的硫代硫酸钠的物质的量为:cmol•L-1×V×10-3L=cV×10-3mol,根据氧化还原反应中电子守恒及题中反应方程式可得关系式:CaO2~I2~2S2O32-,过氧化钙的物质的量为:n(CaO2)=$\frac{1}{2}$n(S2O32-)=$\frac{1}{2}$×cV×10-3mol,样品中CaO2的质量分数为:$\frac{\frac{1}{2}×cV×10{\;}^{-3}mol×72g/mol}{ag}$×100%=$\frac{0.36cV}{a}$,
故答案为:当滴入最后一滴标准溶液时溶液由蓝色变为无色(或溶液褪色),且半分钟不变色;$\frac{0.36cV}{a}$;
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能偏高,因为在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高;
故答案为:偏高;在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高.
点评 本题考查形式为物质制备流程图题目,涉及中和滴定中的误差分析、物质的检验及化学计算等问题,题目难度较大,做题时注意分析题中关键信息、明确实验基本操作方法,本题较为综合,充分考查了学生的分析、化学实验、化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{19}^{40}$K与${\;}_{20}^{40}$Ca | B. | T2O与 H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 石墨和碳纳米管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸 小苏打 硫酸钾 | B. | 硅酸 熟石灰 生石灰 | ||
| C. | 硫酸 烧碱 硫酸铝 | D. | 盐酸 纯碱 食盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯聚合为聚乙烯高分子材料 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 以铜和浓硫酸为原料生产硫酸铜 | D. | 以铜和浓硝酸为原料生产硝酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
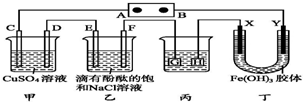 如图装置所示,C、D、E、F、X、Y都是惰性电极,A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.下列叙述正确的是( )
如图装置所示,C、D、E、F、X、Y都是惰性电极,A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.下列叙述正确的是( )| A. | A是电源的负极 | |
| B. | 若C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为2:1:1:1 | |
| C. | 用丙装置给铜件镀银,则G应是铜件 | |
| D. | 丁中Y极附近的颜色逐渐变深,表明Fe(OH)3胶体胶粒带正电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是高分子化合物 | |
| B. | 天然蛋白质仅由碳、氢、氧、氮四种元素组成 | |
| C. | 在一定条件下能水解最终生成多肽 | |
| D. | 氨基酸和蛋白质Shp-2都只能与碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
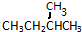
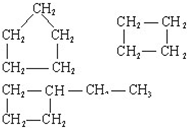 E.
E.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com