
【题目】现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为 ( )

A.1:3B.2:3
C.6:1D.3:1
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”(夹持装置未画出)的说法正确的是( )

A.加热时,①中上部汇集了 NH4Cl 固体,说明 NH4Cl 的热稳定性比较好
B.加热时,②中溶液变红,冷却后又都变为无色
C.加热时,③中溶液变红,冷却后红色褪去,体现了 SO2 的漂白性
D.加热时,④中上部聚集了固体碘,说明碘的热稳定性较差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下:

回答下列问题:
(1)A的名称是____,H中官能团名称是____;
(2)反应①的反应条件为____;
(3)反应⑥的化学方程式为________;反应类型为____。
(4)反应⑦除生成H外,还生成了另一种有机产物的结构简式为____。
(5)符合下列条件的G的同分异构体有____种。
I.能发生银镜反应 Ⅱ.苯环上一氯取代物只有一种 Ⅲ.核磁共振氢谱有4组峰
(6)仿照H的合成路线,设计一种由B合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮的变化关系图如图:
![]()
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.上述路线的所有反应中只有I属于氮的固定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:

(1)上述反应中生成二氧化硫的化学方程式为__。
(2)乙同学认为还可能产生氢气的理由是__。
(3)丙同学在安装好装置后,必须首先进行的一步操作是__。
(4)A中加入的试剂可能是__,作用是__;B中加入的试剂可能是__,作用是__;E中加入的试剂可能是__,作用是__。
(5)可以证明气体X中含有氢气的实验现象是:
C中:__,
D中:__。
如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?__(填“能”或“不能”),原因是_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物麻黄碱和牛磺酸的结构简式如图。有关麻黄碱、牛磺酸的叙述正确的是
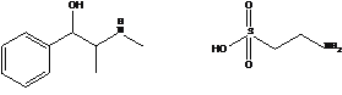
麻黄碱 牛磺酸
A.分子式分别为 C10H16ON、C2H7NO2S
B.均能发生取代反应,麻黄碱还能发生加成反应
C.均能与金属钠及氢氧化钠溶液反应
D.牛磺酸与HSCH2CH( NH2)COOH( 半胱氨酸) 互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。根据已知信息回答下列问题:
(1)已知:P和Cl2分两步反应生成1mol PCl5的热化学方程式:
P(s)+3/2Cl2(g)![]() PCl3(g) △H1=-306kJ/mol
PCl3(g) △H1=-306kJ/mol
Cl2(g)+PCl3(g)![]() PCl5(g) △H2=-93kJ/mol
PCl5(g) △H2=-93kJ/mol
①P和Cl2一步反应生成1molPCl5的△H3=______________ kJ/mol。
②工业上制备PCl5通常也分两步进行,通常将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5,原因是____________________________________________。
③PCl5与足量水充分反应,最终生成两种酸,其中一种是P的最高价含氧酸,其化学方程
式是________________________________________________________。
(2)反应PCl3(g)+Cl2(g)![]() PCl5(g)在容积为10L的密闭容器中进行。起始时PCl3和Cl2均为0.2mol,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
PCl5(g)在容积为10L的密闭容器中进行。起始时PCl3和Cl2均为0.2mol,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
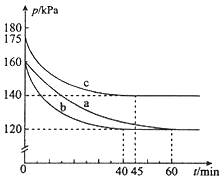
温馨提示:同温同容下的气体,压强之比就等于物质的量之比
①已知实验b平衡时气体的总物质的量为0.30mol,计算实验b反应开始至达到平衡时的反应速率v(PCl5)=_______________,PCl3的平衡转化率为__________________。
②图中3组实验从反应开始至达到平衡时的反应速率v(PCl5)由小到大的次序为____(填实验序号);与实验a相比,c组改变的实验条件是升高温度,判断依据是_________,若α表示PCl3的平衡转化率,实验a和c的平衡转化率:αa______αc(填“<”或“>”);b组改变的实验条件是加入了催化剂,判断依据是_______________________________。
③用p0表示开始时总压强,p表示平衡时总压强,则α(表示PCl3的平衡转化率)的表达式为____(用p0,p表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用分类和氧化还原反应的知识能实现物质的转化。
(1)请从下列试剂中选择合适的完成指定转化(试剂可以重复选择)。
试剂:浓硫酸、I2、NaOH、NaCl、HCl
①HBr→Br2的化学方程式:___;
②V2O5(酸性氧化物)→VO![]() 的离子方程式:___。
的离子方程式:___。
(2)利用含碘酸性废水(其中碘主要以IO![]() 形式存在)为原料生产CuI,其流程如图:
形式存在)为原料生产CuI,其流程如图:

①写出“反应Ⅰ”的离子方程式为___;
②写出“反应Ⅱ”的离子方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com