
| ||
| ||


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
| A、X的原子序数比Y的小 |
| B、X原子的最外层电子数比Y的大 |
| C、X的原子半径比Y的小 |
| D、X元素的最高正价比Y的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
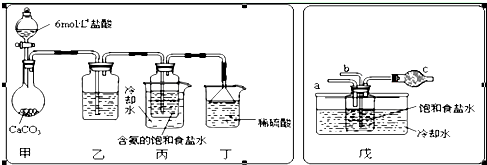
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在5L密闭容器中加入2mol Fe(s)与1mol H2O(g),t1秒时,H2的物质的量为0.20mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol.
在5L密闭容器中加入2mol Fe(s)与1mol H2O(g),t1秒时,H2的物质的量为0.20mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com