
【题目】下列关于图示四个装置的叙述不正确的是


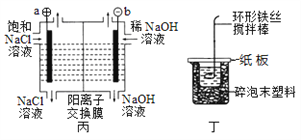
A. 装置甲是可以在铁钉上镀铜的装置
B. 装置乙若为电解精炼铜装置,则X电极为精铜
C. 装置丙的a端产生的气体能使湿润的淀粉碘化钾试纸变蓝
D. 装置丁可用于测定化学反应的反应热
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某硫酸工业废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等。回收废渣中金属元素的工艺流程如下:

已知常温条件下:
①阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol·L-1 )时的pH 如下表所
示。
阳离子 | Fe3+ | Al3+ | Mg2+ |
开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
恰好完全沉淀时的pH | 3.2 | 5.2 | 11.0 |
②饱和氨水溶液中c(OH-)约为1×10-3mol·L-1。
请回答下列问题:
(1)固体C为_________(填化学式)。
(2)上述流程中两次使用试剂X,试剂X是_________(填“氨水”或“氢氧化钠”),其理由是_________________。
(3)溶液D→固体E的过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________________。
(4)写出溶液F→溶液H 的离子方程式:__________________。
(5)Ksp[Mg (OH )2]=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为N2O(g)+CO(g) CO2(g)+N2(g) △H,有关化学反应的物质变化过程(图1)及能量变化过程(图2)如下:

下列说法正确的是( )
A.由图1可知:△H1=△H+△H2
B.由图2可知△H =-226 kJ/mol
C.为了实现转化需不断向反应器中补充Pt2O+和Pt2O2+
D.由图2可知该反应正反应的活化能大于逆反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A 气体为直线型分子;B、C气体在标况下的密度均为1.25g/L;反应①②反应机理类似且原子利用率均为 100%;请回答下列问题:
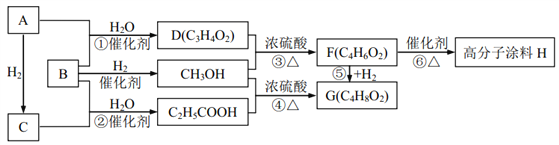
(1)D 中含有的官能团的名称为________________________;
(2)高分子涂料 H 的结构简式为________________________;
(3)下列说法正确的是(___)
A.鉴别有机物 A、 C 可以选用溴的四氯化碳溶液,褪色的是 A
B.反应⑤既是加成反应,又是还原反应,而且原子利用率为 100%
C.高分子涂料 H 含有碳碳双键,所以可以使酸性高锰酸钾溶液褪色
D.反应③④中浓硫酸的作用为催化剂和吸水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年科学家发明的一种新型可控电池——锂水电池,工作原理如图所示。下列有关说法不正确的是( )

A. 石墨极发生的反应是2H2O+2e— === H2↑+2OH—
B. 有机电解质和水溶液不可以互换区域
C. 该装置不仅可提供电能,还可得到清洁的氢气
D. 标准状况下产生22.4 L的氢气时,正极消耗锂的质量为14 g
【答案】D
【解析】A、根据图示信息可知,石墨电极上产生H2,则石墨电极为正极,电极反应为:2H2O+2e=H2↑+2OH,故A正确;B、Li和有机电解质不反应,而Li和水反应,若Li和水接触,会有部分化学能直接转化为热能,所以有机电解质和水溶液不可以换区域,故B正确;C、该原电池是将化学能转化为电能的装置,装置不仅可提供电能,并且反应产物是氢气,能提供氢能源,故C正确;D、金属锂是负极,故D错误。故选D。
【题型】单选题
【结束】
26
【题目】一种新型的“锂-呼吸CO2电池”,结构如图所示,下列说法不正确的是

A. 该装置是化学能转变为电能
B. 利用该技术可减少温室气体CO2的排放
C. 正极的电极反应为:2CO2 + 2e- = C2O42-
D. 每生成10.2g Li2C2O4,有0.2mol Li+从正极迁移至负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 22g N2O和CO2组成的混合气体中所含的氧原子总数为1.5NA
B. 0.1mol·L-1的氨水溶液中,NH3·H2O和NH4+的数目之和为0.1NA
C. 一定质量的Fe溶于稀硝酸中,当产生22.4L NO时,转移电子数为3NA
D. 常温下78g质量分数为26%的乙炔的苯溶液中,含有碳原子的数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图的虚线框中每一列、每一行相当于课本附录的元素周期表的每一族和每一周期,并已标出氢元素的位置,但它的列数和行数都多于元素周期表。请在虚线框中用实线画出周期表第一至第五周期的轮廓,并画出金属与非金属的分界线________。

(2)部分短周期主族元素的原子半径及主要化合价
元素 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 | 庚 | 辛 |
原子半径(nm) | 0.077 | 0.143 | 0.111 | 0.104 | 0.066 | 0.186 | 0.037 | 0.099 |
主要化合价 | +4,-4 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
①乙元素的原子结构示意图____________,丙在元素周期表中的位置___________,戊、庚、辛以原子个数比1∶1∶1形成的化合物的结构式______________。
②甲的单质与丁的最高价氧化物的水化物反应的化学方程式是___________,辛的单质与己的最高价氧化物的水化物反应的离子方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱电解质的电离平衡常数 (25℃)。
电解质 | 电离方程式 | 平衡常数K |
CH3COOH | CH3COOH | 1.76 × 10 -5 |
H2CO3 | H2CO3 HCO3— | K1=4.31 × 10 -7 K2=5.61 × 10 -11 |
C6H5OH | C6H5OH | 1.1 × 10 -10 |
H3PO4 | H3PO4 H2PO4— HPO42— | K1=7.52 × 10 -3 K2=6.23× 10 -8 K3=2.20× 10 -13 |
NH3·H2O | NH3·H2O | 1.76× 10 -5 |
回答下列问题(C6H5OH为苯酚):
(1)由上表分析,若 ① CH3COOH ② HCO3— ③ C6H5OH ④ H2PO4— 均可看作酸,则它们酸性由强到弱的顺序为___________(填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式:__________________________;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO—)______c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10 mL 0.01 mol/L苯酚溶液中滴加V mL 0.01 mol/L氨水,混合溶液中粒子浓度关系正确的是______;
A.若混合液pH>7,则V≥ 10
B.若混合液pH<7,则c((NH4+) >c (C6H5O—) >c (H+)>c (OH—)
C.V=10时,混合液中水的电离程度小于10 mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O—)+ c (C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com