
����Ŀ������п�̵�����ճ����������������ĵ�أ��乹����ͼ��ʾ���ŵ�ʱ�ܷ�ӦΪ��Zn+2H2O+2MnO2=Zn(OH)2+2MnOOH��
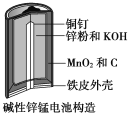
�ӷϾɼ���п�̵���л���Zn��MnO2�Ĺ�����ͼ��ʾ��
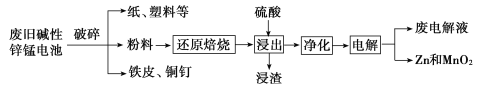
�ش��������⣺
(1)MnOOH�У�MnԪ�صĻ��ϼ�Ϊ_________��
(2)����ԭ�����������У��۽��������ﱻ��ԭΪ�ͼ���������������(����MnOOH��MnO2����ԭ��MnO)����Ҫԭ�������������к���_________��
(3)����������Ϊ�˳�ȥ����Һ�е�Fe2���������ǣ�����______(�ѧʽ)��Һ��Fe2������ΪFe3�����ٵ���pHʹFe3��������ȫ�������£���֪����Һ��Mn2����Zn2����Ũ��ԼΪ0.1 mol/L�������������ݼ��㣬����pH�ĺ�����Χ��______��__________��(����Ũ��С��1��10��5 mol/L��Ϊ������ȫ)
������ | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp����ֵ | 10��13 | 10��17 | 10��38 |
(4)�������ʱ�������ĵ缫��ӦʽΪ_________����������Ӧѭ�����õ�������_______(�ѧʽ)��
(5)������������ֱ�������Ṳ�ȷ�Ӧ����ˣ���Һ����Ҫ�ɷ���ZnCl2��MnCl2��������һ�ֻ���ɫ���壬���������е�MnOOH�����ᷴӦ�Ļ�ѧ����ʽΪ__________��
���𰸡���3 C H2O2(��KMnO4) 3 6 Mn2��-2e��+2H2O=MnO2��4H�� H2SO4 2MnOOH+6HCl![]() Cl2��+2MnCl2+4H2O
Cl2��+2MnCl2+4H2O
��������
(1)���ݻ��ϼ۴�����Ϊ0���㣻
(2-4)�Ͼɼ���п�̵�ط����к���̼���л�ԭ�ԣ�����ԭ�����������У�̼���۽��������ﱻ��ԭΪ�ͼ���������������(����MnOOH��MnO2����ԭ��MnO)�����������ܽ�����п��MnO�õ�MnSO4��Һ������Fe2+��Zn2+�����������м���H2O2��Һ������Fe2+����ΪFe3+���ٵ���pHʹFe3+��ȫ���������յõ�MnSO4��Һ��Zn2+���������Mn2+ʧ���ӷ���������Ӧ����MnO2������Zn2+�õ��ӷ�����ԭ��Ӧ����Zn���ϵ��ҺΪ���ᣬ�ݴ˷������
(5)����MnOOH���������ԣ������ᷢ��������ԭ��Ӧ��д��ѧ����ʽ��
(1)���ݻ��ϼ۴�����Ϊ0����MnOOH�У�OΪ-2�ۣ�HΪ+1�ۣ�����MnԪ�صĻ��ϼ�Ϊ+3�ۣ�
(2)�Ͼɼ���п�̵�ط����к���̼���л�ԭ�ԣ�����ԭ�����������У�����̼���۽��������ﱻ��ԭΪ�ͼ��������������ʣ�����MnOOH��MnO2����ԭ��MnO����
(3)����������Ϊ�˳�ȥ����Һ�е�Fe2+������H2O2��Һ���������Խ�Fe2+����ΪFe3+������Mn(OH)2��Zn(OH)2��Ksp����ֵ�����Mn2+��Zn2+��ʼ����ʱ��������Ũ�ȷֱ�Ϊ
![]() =10-6��
=10-6��![]() =10-8����Mn2+��Zn2+��ʼ����ʱ��pH�ֱ�Ϊ8��6����Fe(OH)3������ȫʱ��������Ũ��Ϊ
=10-8����Mn2+��Zn2+��ʼ����ʱ��pH�ֱ�Ϊ8��6����Fe(OH)3������ȫʱ��������Ũ��Ϊ![]() =10-11��Fe(OH)3������ȫʱ��pHΪ3�����Ե���pH�ĺ�����Χ�� 3��6��ʹFe3+��ȫ������Mn2+��Zn2+��������
=10-11��Fe(OH)3������ȫʱ��pHΪ3�����Ե���pH�ĺ�����Χ�� 3��6��ʹFe3+��ȫ������Mn2+��Zn2+��������
(4)���ʱ��������Mn2+ʧ���ӷ���������Ӧ������Һ�е�ˮ������Ӧ����MnO2��ˮ���������ĵ缫��ӦʽΪMn2+-2e-+2H2O=MnO2+4H+������������Һ�е�Zn2+�õ��ӷ�����ԭ��Ӧ���ɵ���Zn���ϵ��ҺΪ���ᣬ��˱�������Ӧѭ�����õ�������H2SO4��
(5)���������е�MnOOH���������ԣ������ᷢ��������ԭ��Ӧ������MnCl2��Cl2��H2O�����ݵ����غ㡢ԭ���غ㣬�ɵø÷�Ӧ�Ļ�ѧ����ʽΪ2MnOOH+6HCl![]() 2MnCl2+Cl2��+4H2O��
2MnCl2+Cl2��+4H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȷ��ʾ���з�Ӧ�����ӷ�Ӧ����ʽΪ
A.��FeBr2��Һ��ͨ������������2Fe2++4Br��+3Cl2�T2 Fe3++2 Br2+6Cl��
B.��������Һ�еμ�Ba��OH��2��Һ��ǡ��ʹSO42��������ȫ��![]()
C.![]() ϡ��Һ�������KOH��Һ��Ӧ��
ϡ��Һ�������KOH��Һ��Ӧ��![]()
D.�����ȥˮ����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС����ȡ��������������������ʵ�飬��װ����ͼ��ʾ���ش��������⣺
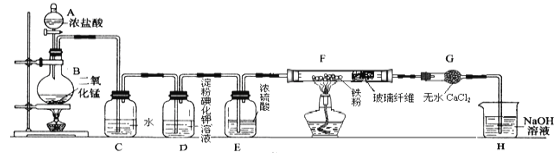
��1������A�������� ______��ʵ�����Ʊ������ķ�Ӧ����ʽΪ ____________________��
��2��C�з�����Ӧ�Ļ�ѧ����ʽΪ ______ �������������ɫ��������C�У��۲쵽�������� ______��ԭ���� ___________________________��
��3��ʵ���й۲쵽D��Һ����ɫ�������ϵ�֪���۵⻯����Һ�ǵ��ۺ͵⻯�أ�KI���Ļ����Һ��д��Dװ���з�����Ӧ�����ӷ���ʽ______________________��
��4��F�����������۷�Ӧ�Ʊ���ˮ���Ȼ�����������֪�û�������غ�ɫ������ˮ���⣬ 100������ʱ������˫ͨ��F�в�����ά�������뷴Ӧ���������� ______ ����F��Hװ��֮�䰲װGװ�õ�Ŀ����____��
��5��H��NaOH��Һ�������� _______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH3OH ��һ����ɫ�д̼�����ζ��Һ�壬����������������Ҫ��;��
��.Ŀǰ��ҵ����һ�ַ������� CO2 ����ȼ�ϼ״���һ�������·�����Ӧ��CO2(g) +3H2(g)=CH3OH(g)+H2O(g)���÷�Ӧ�������仯��ͼ��ʾ��
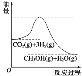
(1)����Ϊ�÷�ӦΪ_____(����Ȼ�����)��Ӧ.
(2)���������У��������Ϸ�Ӧ���ܼӿ췴Ӧ���ʵ���_____��
a�������¶� b������ He c��������� d������ѹǿ
��. CH3OH Ҳ��һ����Ҫ��ȼ�ϣ�һ�������·�����Ӧ��
2CH3OH(g)��3O2(g) =2 CO2(g)��4H2O(g)��
(3)ij�¶��£��� 4mol CH3OH �� 6 mol O2 ���� 2 L ���ܱ������о��� 4 min ��Ӧ�ﵽƽ�⣬��� c(O2)��1.5mol��L��1��4 min ��ƽ����Ӧ���� ��(H2O)��_____��
(4)CH3OH ȼ�ϵ����Ŀǰ������ɹ���ȼ�ϵ��֮һ������ȼ�ϵ���ɼ״�������(����)��KOH(�������Һ)���ɡ�������˵����ȷ����_____(�����)��
�ٵ�طŵ�ʱͨ������ĵ缫Ϊ����
�ڵ�طŵ�ʱ���������Һ�ļ�������
�۵�طŵ�ʱÿ���� 6.4 g CH3OH ת�� 1.2 mol ����
(5)�� CH3OH������(����)������������ҺΪԭ�ϣ�ʯīΪ�缫����ȼ�ϵ�أ��õ���и����ϵĵ缫��Ӧʽ�ǣ�____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ļ�������ũҩ��������ҵ����ҵ��������;�dz��㷺���������ʾ�ش�����������⣺
(1)��̬��ԭ�ӵĵ����Ų�ʽΪ____��̼��������Ԫ�صĵ�һ��������С�����˳��Ϊ______(��Ԫ�ط��ű�ʾ)��
(2)NH4Cl�������ӵĿռ乹��Ϊ______����NH4+��Ϊ�ȵ������һ�ַǼ��Է��ӵĻ�ѧʽΪ________��
(3)NH4Cl�����ֽ������������CuSO4��Һ��ͨ�백����������������ɫ�������������ܽ�õ�����ɫ��Һ������Һ�д��ڵ������ӵĽṹʽΪ_______����λ��������ʾ����
(4)GaAs��GaN��Ϊԭ�Ӿ��壬GaAs�۵�Ϊ1238�棬GaN�۵�ԼΪ1500����GaAs�۵����GaN��ԭ��Ϊ_________��
(5)GaAs�ľ����ṹ��ͼ��ʾ������Asԭ���γɵĿ�϶���������������κ����������Σ��þ�����Gaԭ��������϶����Ϊ_______����֪GaAs���ܶ�Ϊ�� g/cm3��Ga��As��Ħ�������ֱ�Ϊ MGa g/mol��MAsg/mol������٤��������ֵΪNA����GaAs������Ga֮�����̾���Ϊ_______pm��д������ʽ����
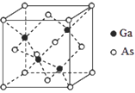
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС��ͬѧȡV LŨ���ĺ�ˮ������ͼ��ʾװ��ģ�ҵ�����塣�ش��������⣺
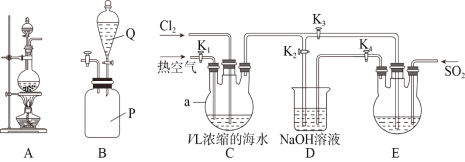
��1��װ��A������ʵ�����Ʊ��������䷴Ӧԭ��Ϊ________________________________(�����ӷ���ʽ��ʾ)��װ��B��SO2����ƿ����Q�е���ҺΪ________________��
��2����ĸ������̣�
��ͨ��������ͨ���ȿ�����˳������ͨ______________��ͨ������ʱK1��K2��K3�Ĺء�����ʽ��___________________��
��װ��D��������_______________________________��ͨ��SO2ʱװ��E�з�����Ӧ�Ļ�ѧ����ʽΪ______________________________________��
��3����ľ��ƣ�
�ٴ�װ��E��Br-ȫ��ת��Ϊ���ʺ���������ͼ�е�____________(����ĸ)װ�ý������ɵõ����塣
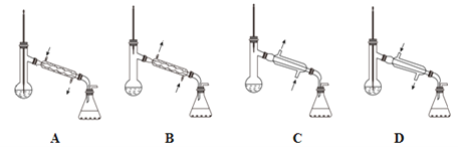
�ڼ������յõ�m g���壬ʵ�������������Ϊb%����Ũ����ˮ��c(Br-)=______________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֱ����뷴Ӧ����ʽ��Ӧ����ȷ���� ( )
A. �������е���AgNO3��Һ�������е���Ԫ�أ�Br-+Ag+ = AgBr��
B. �ô����ȥˮ����CaCO3 + 2H+ = Ca2+ + H2O + CO2��
C. ��������Һͨ������CO2��![]()
D. ʵ������Һ��ͱ��ڴ������������屽��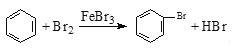
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C����ѧ��ѧ�������������ʣ�����֮����ת����ϵ������ʾ(���ַ�Ӧ������������ȥ)��
![]()
![]()
![]()
![]()
![]()
(1)��A��һ�ֵ���ɫ���嵥�ʣ���C��H2O��Ӧ��������Ϊ______(�ѧʽ)��
(2)��C��һ�ֵ���ɫ���廯�����C��CO2��Ӧ�Ļ�ѧ����ʽ______________________________��
(3)��A����ͼ��ʾװ���Ƶã���B��C��Ϊ����Ⱦ���������壬��д��Aת����B�Ļ�ѧ����ʽ��________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ϩ��![]() ������Ҫ���л�����ԭ�ϣ��㷺����ũҩ�������ϵ��������ش��������⣺
������Ҫ���л�����ԭ�ϣ��㷺����ũҩ�������ϵ��������ش��������⣺
��1����֪��![]() (g) =
(g) = ![]() (g)+H2(g) ��H1=100.3 kJ��mol 1 �٣�H2(g)+ I2(g) =2HI(g) ��H2=11.0 kJ��mol 1 �ڣ����ڷ�Ӧ
(g)+H2(g) ��H1=100.3 kJ��mol 1 �٣�H2(g)+ I2(g) =2HI(g) ��H2=11.0 kJ��mol 1 �ڣ����ڷ�Ӧ![]() (g)+ I2(g) =
(g)+ I2(g) =![]() (g)+2HI(g) �ۦ�H3=___________kJ��mol 1��
(g)+2HI(g) �ۦ�H3=___________kJ��mol 1��
��2��ij�¶��£������ʵ����ĵ�ͻ���ϩ��![]() ���ڸ��������ڷ�����Ӧ�ۣ���ʼ��ѹΪ105Pa��ƽ��ʱ��ѹ������30%������ϩ��ת����Ϊ___���÷�Ӧ��ƽ�ⳣ��Kp=____Pa���ﵽƽ��������ӻ���ϩ��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��_____�����ţ���
���ڸ��������ڷ�����Ӧ�ۣ���ʼ��ѹΪ105Pa��ƽ��ʱ��ѹ������30%������ϩ��ת����Ϊ___���÷�Ӧ��ƽ�ⳣ��Kp=____Pa���ﵽƽ��������ӻ���ϩ��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��_____�����ţ���
A��ͨ��������� B������¶� C�����ӻ���ϩŨ�� D�����ӵ�Ũ�� E��ʹ�ú��ʴ���
��3�������ϩ�������ۺ����ɶ����壬�÷�ӦΪ���淴Ӧ����ͬ�¶��£���Һ�л����ϩŨ���뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ������˵����ȷ����____�����ţ���

A��T1��T2 B��a��ķ�Ӧ����С��c��ķ�Ӧ����
C��a�������Ӧ���ʴ���b����淴Ӧ���� D��b��ʱ�������Ũ��Ϊ0.45 mol��L1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com