
����Ŀ���Ҷ��ᣨHOOC��COOH���ɼ�дΪH2C2O4���׳Ʋ��ᣬ��100�濪ʼ������157��ʱ��ʼ�ֽ⣮
(1)̽�����������
����֪��25��H2C2O4�ĵ��볣�� K1=5.4��10-2��K2=5.4��10-5��H2CO3�ĵ��볣�� K1=4.5��10-7��K2=4.7��10-11�������л�ѧ����ʽ��ȷ����___����ѡ����ţ���ͬ��
A��H2C2O4+CO32-=HCO3-+HC2O4- B��HC2O4-+CO32-=HCO3-+C2O42-
C��H2O+CO2+C2O42-=HC2O4-+HCO3- D��C2O42-+CO2+H2O=H2C2O4+CO32-
����1L 0.02mol/L H2C2O4��Һ�еμ�1L 0.01mol/L NaOH��Һ�������Һ��c��H+����c��OH����������˵������ȷ����___��
A��c��H2C2O4����c��HC2O4-��
B��c��Na+��+c��H+��=2c��C2O42-��+c��HC2O4-��+c��OH����
C��c��OH����=c��H+��+2c��H2C2O4��+c��HC2O4-��
D��c��H2C2O4��+c��C2O42-��+c��HC2O4-��=0.02mol/L
(2)������KMnO4��Һ�ζ������ʵ�Na2C2O4��Ʒ����֪���ʲ���KMnO4��H2SO4��Һ��Ӧ����
ʵ�鲽�裺ȷ��ȡ1g��ƷNa2C2O4���壬���100mL��Һ��ȡ��20.00mL����ƿ�У�����ƿ�м�������ϡH2SO4��Һ����0.016mol/L���������Һ�ζ����ζ����յ�ʱ���ĸ��������Һ25.00mL������֪��5H2C2O4+2KMnO4+3H2SO4=10CO2��+2MnSO4+K2SO4+8H2O��
���������ҺӦװ��__________�ζ����С���������ʽ��������ʽ����
�ڵζ����յ�ʱ��ʵ�������ǣ�__________________________________________��
�����в�������ʹ�������ƫ�ߵ���_____________��
A��ʢװ��Na2C2O4�ĵζ���û��ϴ
B��ʢװ���������Һ�ĵζ��ܵζ�ǰ���촦�����ݣ��ζ���������ʧ
C������ʱ�ζ�ǰ���ӣ��ζ����� D����ƿ�в�������ˮ
�ܼ�����Ʒ��Na2C2O4�Ĵ���____________________��
���𰸡�B B ��ʽ ��ɫ��Ϊdz��ɫ��dz�Ϻ�ɫ�����Ұ�����ڲ���ɫ B 67%
��������
(1)�ٸ��ݲ����̼��ĵ���ƽ�ⳣ���ж�����ǿ����Ȼ������ǿ���û������ԭ�������жϣ�
��A����Һ��ʾ���ԣ�˵������ĵ���̶ȴ��ڲ���������ӣ�
B��������Һ�еĵ���غ��жϣ�
C��������Һ��ʾ���Է�����
D��������Һ�е������غ��жϣ�
(2)�ٸ������Ը��������ҺΪ���ԡ�����ǿ�����Է�����
�ڸ��ݵζ�����ǰΪ��ɫ���ζ�������Ϊdz��ɫ�жϵζ��յ㣻
�۷�����ӦΪ2MnO4-+5C2O42-+16H+=10CO2��+2Mn2++8H2O�����ݵζ�������c=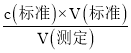 ��Ӱ�������
��Ӱ�������
���ȼ����20mL��Ʒ��Һ���ĸ�����ص����ʵ������ټ����100mL��Ʒ��Һ���ĸ�����ص����ʵ�����Ȼ����ݷ�Ӧ��������IJ����Ƶ����ʵ���������m=nM�����1g��������Ʒ�к��в����Ƶ����������������Ʒ�Ĵ��ȡ�
(1)����25��H2C2O4 K1=5.4��10��2��K2=5.4��10��5��H2CO3 K1=4.5��10��7��K2=4.7��10��11��֪���Դ�СΪ��H2C2O4��HC2O4����H2CO3��HCO3����
��A������HC2O4����H2CO3���������̼������ӷ�Ӧ���ɶ�����̼����Ͳ�������ӣ���ȷ�ķ�ӦΪ��H2C2O4+CO32��=CO2��+H2O+C2O42������A����
B��HC2O4����H2CO3��HCO3�������������������ʱ��������Ӧ��HC2O4��+CO32��=HCO3��+C2O42������B��ȷ��
C������HC2O4����H2CO3����Ӧ��H2O+CO2+C2O42��=HC2O4��+HCO3�����ᷢ�����ʴ���
D������HC2O4����H2CO3��̼�����û������ᣬ�÷�ӦC2O42��+CO2+H2O�TH2C2O4+CO32�����ᷢ������D����
�ʴ�ΪB��
����1L 0.02mol/L H2C2O4��Һ�еμ�1L 0.01mol/L NaOH��Һ����Ӧ������Ϊ��Ũ�ȵ�H2C2O4��NaHC2O4�������Һ��c(H+)��c(OH��)��
A������ĵ���̶ȴ���HC2O4���ĵ��룬����Һ��c(H2C2O4)��c(HC2O4��)����A����
B�����ݵ���غ�ɵã�c(Na+)+c(H+)�T2c(C2O42��)+c(HC2O4��)+c(OH��)����B��ȷ��
C����Һ�����ԣ�c(OH��)��c(H+)����c(OH��)��c(H+)+2c(H2C2O4)+c(HC2O4��)����C����
D�����������غ�ɵã�c(H2C2O4)+c(C2O42��)+c(HC2O4��)=0.01mol/L����D����
�ʴ�ΪB��
(2)�����Ը��������Һ�����ԣ��Ҿ���ǿ�����ԣ��ܹ�������ʽ�ζ��ܵ��ܣ�����Ӧ������ʽ�ζ�����ȡ��
�ڵζ�����ǰ��ҺΪ��ɫ���ζ���������Һ��dz��ɫ�����Եζ��յ������Ϊ����ɫ��Ϊdz��ɫ(��dz�Ϻ�ɫ)���Ұ�����ڲ���ɫ��
��A��ʢװ��Na2C2O4�ĵζ���û��ϴ�����´���ҺŨ�ȼ�С����ⶨ���ƫС����A����
B��ʢװ���������Һ�ĵζ��ܵζ�ǰ���촦�����ݣ��ζ���������ʧ���������ĵı�Һ���ƫ�ⶨ���ƫ�ߣ���B��ȷ��
C������ʱ�ζ�ǰ���ӣ��ζ����ӣ������ĸ��������Һ���ƫС���ⶨ���ƫ�ͣ���C����
D����ƿ�в�������ˮ���Բⶨ�����Ӱ�죬��D����
�ʴ�ΪB��
��25.00mL 0.016mol/L���������Һ�к��и�����ص����ʵ���Ϊ��0.016mol/L��0.025L=0.0004mol��100mL����Ʒ��Һ��ȫ��Ӧ���ĸ�����ص����ʵ���Ϊ��0.0004mol��5=0.002mol�����ݷ�Ӧ2MnO4��+5C2O42��+16H+=10CO2��+2Mn2++8H2O��֪��1gNaspan>2C2O4������Ʒ�к��в����Ƶ����ʵ���Ϊ��0.002mol��![]() =0.005mol������Ϊ��134g/mol��0.005mol=0.67g������Na2C2O4�Ĵ���Ϊ��
=0.005mol������Ϊ��134g/mol��0.005mol=0.67g������Na2C2O4�Ĵ���Ϊ��![]() ��100%=67%��
��100%=67%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ�Ļ������ڻ���������ҩ��ϳ�������Ҫ��;��ij��ȤС����һ�ֹ�ҵ����(��Ҫ�ɷ�ΪMgCO3��MgSiO3������Fe��������)Ϊԭ���Ʊ�MgCO3��3H2O��ʵ��������£�

(1)�����ijɷ�Ϊ_________________(�ѧʽ)������װ����ʹ��һ��ʱ�������NaOH��Һ��ϴ���û�ѧ����ʽ��ʾ����ϴԭ����______________��
(2)����H2O2һ��ʱ�����Һ�������ݳ��ֲ����ȣ������������ݵ�ԭ��____________(�����ֱ���)��
(3)��ȡ��Һ��Ҫ�õ���Һ©������Һ©����ʹ��ǰ��ϴ�ɾ���____________________����ȡ��Һ��Ŀ����______________(����ĸ)��
A.��ȥˮ��Һ�е�������
B.����þ������ˮ�е��ܽ��
C.������Ԫ�أ����Ի�������
(4)��ȡ��õ���ˮ��Һ�Ʊ�MgCO3��3H2O��ʵ��������߽��������Һ�еμ�Na2CO3��Һ���д����������ɣ����ú��в�����______________________________��ȷ��������ȫ���ٹ��ˡ�__________________��__________________���õ�MgCO3��3H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�����£�ϡ��![]() ��HClO�������ϡ��Һʱ����ҺpH���ˮ���ı仯������˵����ȷ����
��HClO�������ϡ��Һʱ����ҺpH���ˮ���ı仯������˵����ȷ����![]()

A.��ͬŨ�ȵ�![]() ��NaClO�Ļ����Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�
��NaClO�Ļ����Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�![]()
B.��Ũ�ȵ������![]() ��NaClO������Һ�У������ӵ������ʵ���ǰ��С�ں���
��NaClO������Һ�У������ӵ������ʵ���ǰ��С�ں���
C.ͼ��a��b�����Ӧ��������ʵ���Ũ��![]()
D.ͼ��a��c�������Һ�� ���
���![]() ����
����![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.��ͬ�����£����![]() ��Һ��pH������ͬ���ʵ���Ũ�ȵ�
��Һ��pH������ͬ���ʵ���Ũ�ȵ�![]() ��Һ��˵���ǽ����ԣ�
��Һ��˵���ǽ����ԣ�![]()
B.���������У���50mL1![]() �������м����ռˮ��
�������м����ռˮ��![]() ����
����
C.��ͬ�¶�ʱ��![]() �ֱ�����ͬ���ʵ���Ũ�ȵ�
�ֱ�����ͬ���ʵ���Ũ�ȵ�![]() ��Һ��
��Һ��![]() ��Һ�е��ܽ����ͬ
��Һ�е��ܽ����ͬ
D.��HX��HY��������������![]() �������ʵ���Ũ����ͬ��NaX��NaY����Һ�������ϵ���Һ����
�������ʵ���Ũ����ͬ��NaX��NaY����Һ�������ϵ���Һ����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2�ĺ����ǿ��������ձ���һ����Ҫ���ָ�꣬Ҳ���������������Ű�ҹ��ֵ�������Ҫԭ��֮һ���Ӵ�SO2�Ĵ������ȣ�������������Ⱦ�ĵ���֮����
I���绯ѧ������SO2��
���Ṥҵβ���е�SO2������������Ʊ����ᣬͬʱ��õ��ܣ�װ������ͼ��ʾ���缫��Ϊ���Բ��ϣ���

��1��M�������ĵ缫��ӦʽΪ________________��
��2����ʹ��װ�õĵ���ǿ�ȴﵽ2��0A��������ÿ����Ӧ��ͨ���״������������Ϊ________L����֪��1��e-��������Ϊ1.6��10-19C����
��.��Һ��绯ѧ�ۺϣ��Ƽ�ѭ����������SO2��
��3���Ƽ�ѭ�����У���Na2SO3��Һ��Ϊ����Һ������SO2���÷�Ӧ�����ӷ���ʽΪ______________��
��4������Һ����SO2�Ĺ����У�pH��n(SO32-)��n(HSO3-)�仯��ϵ����ͼ��ʾ��
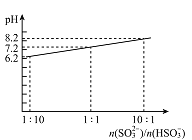
����ͼ�����ݺͱ仯����˵��NaHSO3��Һ�����Ե�ԭ��________________��
��n(SO32-)��n(HSO3-)=1��1ʱ����Һ������Ũ���ɴ�С��˳����_____________��
��5��������Һ��pH����ԼΪ6ʱ�����������۴�����ֱ���õ�pH>8������Һ��ѭ�����ã�����ʾ��ͼ���£�
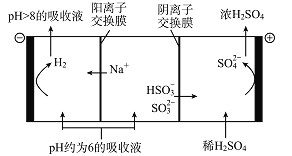
��д�����������ĵ缫��Ӧʽ________________��
�ڵ��缫����2 mol����ת��ʱ�������������Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�HF�ĵ��볣��Ka=6.61��10-4��NH3�qH2O���볣��Kb=1.78��10-5������˵����ȷ����
A.NH4F��Һ��![]()
B.NH4F��Һ��ˮ�ĵ���̶�С�ڴ�ˮ�ĵ���̶�
C.NH4F��Һ��F-��ˮ��ƽ�ⳣ��Kh(F-)=1.51��10-11
D.NH4F��NH4Cl�Ļ����Һ�������й�ϵ��c(NH4+)>c(F-)+c(Cl-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л����
��NaCl����NaOH����HCl����NH4Cl����CH3COONa����CH3COOH����NH3��H2O����H2O
�ش��������⡣
(1)NH4Cl��Һ�� �ԣ������ӷ���ʽ��ʾԭ�� ������Һ������Ũ�ȴ�С˳��Ϊ ��
(2)�����£�pH��11��CH3COONa��Һ�У�ˮ���������c(OH��)�� ����pH��3��CH3COOH��Һ�У�ˮ���������c(H��)�� ��
(3)��֪��ˮ�д�������ƽ�⣺H2O��H2O![]() H3O����OH������H��0������ʹƽ�������ƶ�����������Һ�����ԣ���ѡ��ķ����� (����ĸ���)��
H3O����OH������H��0������ʹƽ�������ƶ�����������Һ�����ԣ���ѡ��ķ����� (����ĸ���)��
A����ˮ�м���NaHSO4����
B����ˮ�м�Na2CO3����
C��������100 ��[����c(H��)��1��10��6 mol��L��1]
D����ˮ�м���(NH4)2SO4����
(4)������pH�����������NaOH��Һ����NH3��H2O��Һ�ֱ��ˮϡ��m����n����ϡ�ͺ�������Һ��pH����ȣ���m (�����������������)n��
(5)����H2O�⣬������7�����ʵ���Һ�����ʵ���Ũ����ͬ������7�����ʵ���Һ��pH�ɴ�С��˳��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ���صĵ�ط�ӦΪ��![]()
![]()
![]()
![]() ����˵����ȷ����
����˵����ȷ����
A.�ŵ�ʱ�������ķ�Ӧʽ�ǣ�![]()
B.�ŵ�ʱ���������Һ�е�H+���ƶ�
C.���ʱ�������ĵ缫��ӦΪ��![]()
D.���ʱ������20.7gPb����ʱ��ת�Ƶĵ���Ϊ0.1mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ksp(CaSO4)=9��10-6��������CaSO4��ˮ�еij����ܽ�ƽ������ͼ������������ȷ���ǣ� ��
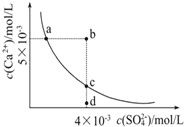
��a��c��������Ա�ʾCaSO4����ˮ���γɵı�����Һ
��a���Ӧ��Ksp������c���Ӧ��Ksp
��b���Ӧ����Һ���г�������
��d����Һͨ�������ܼ����Ա䵽c��
�ݳ�����CaSO4����ˮ�ı�����Һ�У�c(Ca2+)��c(SO42-)�ij˻���Ӧ����������һ��
�����£���100 mL����CaSO4��Һ�м���400 mL0.01 mol/L Na2SO4��Һ����ʹ��Һ��a���Ϊb��
A.2��B.3��C.4��D.5��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com