
【题目】根据下列化合物:
①NaCl;②NaOH;③HCl;④NH4Cl;⑤CH3COONa;⑥CH3COOH;⑦NH3·H2O;⑧H2O
回答下列问题。
(1)NH4Cl溶液显 性,用离子方程式表示原因 ,其溶液中离子浓度大小顺序为 。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)= ,在pH=3的CH3COOH溶液中,水电离出来的c(H+)= 。
(3)已知纯水中存在如下平衡:H2O+H2O![]() H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是 (填字母序号)。
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是 (填字母序号)。
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100 ℃[其中c(H+)=1×10-6 mol·L-1]
D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m (填“<”、“>”或“=”)n。
(5)除⑧H2O外,若其余7种物质的溶液的物质的量浓度相同,则这7种物质的溶液按pH由大到小的顺序为 。
【答案】(1)酸 NH4++H2O![]() NH3·H2O+H+ c(Cl-)>c(NH4+)>c(H+)>c(OH-)
NH3·H2O+H+ c(Cl-)>c(NH4+)>c(H+)>c(OH-)
(2)10-3 mol·L-1 10-11 mol·L-1
(3)D
(4)<
(5)②>⑦>⑤>①>④>⑥>③
【解析】(1)NH4Cl为强酸弱碱盐,由于NH4+水解,其溶液呈酸性,故其溶液中离子浓度的大小关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-)。(2)CH3COONa溶液中由于醋酸根离子的水解促进水的电离,故pH=11的CH3COONa溶液中,水电离出来的c(OH-)=10-3 mol·L-1;在pH=3的CH3COOH溶液中水的电离受到抑制,故水电离出来的c(H+)=10-11 mol·L-1。(3)A项使溶液呈酸性但电离平衡向左移动;B项虽使平衡向右移动但溶液呈碱性;C项操作虽使平衡右移但水仍然呈中性;D项中由于NH4+的水解,促进水的电离而使溶液呈酸性。(4)由于NH3·H2O是弱电解质,存在电离平衡,故m<n。(5)首先将溶液按酸性、中性、碱性分组,然后再排序。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】新华社报道:全国农村应当在“绿色生态·美丽多彩·低碳节能·循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃、101kPa时:
①C(s)+![]() O2(g)=CO(g) ΔH=-126.4kJ/mol
O2(g)=CO(g) ΔH=-126.4kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
③H2O(g)=H2O(l) ΔH=-44kJ/mol
则在25℃、101kPa时:
C(s)+H2O(g)=CO(g)+H2(g) ΔH=_____。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH>0
Fe(s)+CO2(g) ΔH>0
已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值____(填“增大”“减小”或“不变”)。
②1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,则在这种情况下,该反应是否处于化学平衡状态?____(填“是”或“否”),其判断依据是___。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。
现向体积为1L的恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=____。
②下列措施能使![]() 增大的是____(填字母)。
增大的是____(填字母)。
A.升高温度
B.再充入H2
C.再充入CO2
D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关醋酸溶液的叙述中不正确的是
A.pH =4.3的CH3COOH与CH3COONa混合溶液中:c(Na+) < c(CH3COO-)
B.浓度为0.2 mol/L的CH3COOH溶液和浓度为0.1 mol/L的NaOH溶液等体积混合后:c(CH3COO-) - c(CH3COOH) = 2[c(H+) - c(OH-)]
C.醋酸浓溶液加少量水稀释, 几乎不变
几乎不变
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+) = 2[c(HC2O4-) + c(C2O42-) + c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,在100℃开始升华,157℃时开始分解.
(1)探究草酸的酸性
①已知:25℃H2C2O4的电离常数 K1=5.4×10-2,K2=5.4×10-5;H2CO3的电离常数 K1=4.5×10-7,K2=4.7×10-11,则下列化学方程式正确的是___(填选项序号,下同)
A.H2C2O4+CO32-=HCO3-+HC2O4- B.HC2O4-+CO32-=HCO3-+C2O42-
C.H2O+CO2+C2O42-=HC2O4-+HCO3- D.C2O42-+CO2+H2O=H2C2O4+CO32-
②向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液.混合溶液中c(H+)>c(OH﹣),下列说法中正确的是___.
A.c(H2C2O4)>c(HC2O4-)
B.c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH﹣)
C.c(OH﹣)=c(H+)+2c(H2C2O4)+c(HC2O4-)
D.c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.02mol/L
(2)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应).
实验步骤:准确称取1g样品Na2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中.再向瓶中加入足量稀H2SO4溶液,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
高锰酸钾溶液应装在__________滴定管中。(填“酸式”或“碱式”)
②滴定至终点时的实验现象是:__________________________________________。
③下列操作可能使测量结果偏高的是_____________;
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视 D.锥形瓶中残留少量水
④计算样品中Na2C2O4的纯度____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示800℃时,X、Y、Z三种气体物质的浓度随时间变化的情况.试回答:(保留一位小数)
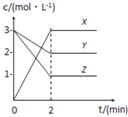
(1)该反应的反应物为 ______ ;
(2)该反应的化学方程式为 ______ ;
(3)0~2minY物质的化学反应速率为 ______ ;
(4)Z物质的平衡转化率为 ______ ;
(5)800℃时,该反应的平衡常数K= ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应![]() ,下列叙述正确的是
,下列叙述正确的是
A.达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减少
B.化学反应速率关系是:![]()
C.达到化学平衡时,![]()
D.若单位时间内生成![]() 的同时,消耗
的同时,消耗![]() ,则反应达到平衡状态
,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化原理为2SO2(g)+O2(g)![]() 2SO3(g)。在一定压强下,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。下列说法不正确的是
2SO3(g)。在一定压强下,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。下列说法不正确的是
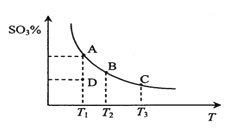
A. 反应2SO2(g)+O2(g)![]() 2SO3(g)的△H<0
2SO3(g)的△H<0
B. 在D点时v(正)<v(逆)
C. 若B、C点的平衡常数分别为KB、KC,则KB>KC
D. 恒温恒压下向平衡体系中通入氦气,平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日,瑞典皇家科学院将诺贝尔化学奖授予古迪纳夫等三位科学家,表彰他们在锂离子电池方面的研究成果,钴酸锂电池是他们的研究成果之一,其工作原理为LixC6+Li1-xCoO2![]() C6+LiCoO2。下列说法正确的是
C6+LiCoO2。下列说法正确的是
A.放电时Li+从正极通过导线流向负极
B.放电时负极的电极反应式为:LixC6-xe-=C6+xLi+
C.充电时电池的负极与电源的正极相连
D.充电时阴极的电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下表为![]() 时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A.向NaClO溶液中通入少量二氧化碳的离子方程式为:![]()
B.相同浓度的![]() 和NaClO的混合溶液中,
和NaClO的混合溶液中,![]()
C.向![]() 溶液中加入少量水,溶液中pH增大
溶液中加入少量水,溶液中pH增大
D.25℃时,![]() 溶液通入
溶液通入![]() 至溶液的
至溶液的![]() 时,溶液中:
时,溶液中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com