
【题目】如图表示800℃时,X、Y、Z三种气体物质的浓度随时间变化的情况.试回答:(保留一位小数)
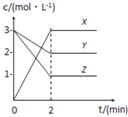
(1)该反应的反应物为 ______ ;
(2)该反应的化学方程式为 ______ ;
(3)0~2minY物质的化学反应速率为 ______ ;
(4)Z物质的平衡转化率为 ______ ;
(5)800℃时,该反应的平衡常数K= ______ .
【答案】Y、Z Y+2Z3X 0.5mol/(Lmin) 66.67% 13.5
【解析】
(1)反应物在反应中浓度降低;
(2)根据物质浓度的变化量确定化学方程式;
(3)根据公式![]() 计算化学反应速率;
计算化学反应速率;
(4)利用Z转化的浓度与起始浓度的比值确定Z的转化率;
(5)先判断出平衡时三种物质的浓度,再代入化学平衡常数表达式计算化学平衡常数。
(1)反应物在反应中浓度降低,根据图象中曲线变化可知Y、Z浓度降低,X浓度增大,则Y、Z为反应物,X为生成物;
故答案为Y、Z;
(2)Y浓度减小了(32)mol/L=1mol/L,Z浓度减小了(31)mol/L=2mol/L,X浓度增大了3mol/L,故化学计量数之比为1:2:3,则化学方程式为:Y+2Z3X;
故答案为:Y+2Z3X;
(3)02minY物质的浓度减小了1mol/L,其化学反应速率为![]() ;
;
故答案为:0.5mol/(Lmin);
(4)Z浓度减小了2mol/L,Z起始浓度为3mol/L,则Z的转化率为:![]() ;
;
故答案为:66.67%;
(5)平衡时,Y浓度为2mol/L,Z浓度为1mol/L,X浓度为3mol/L,则 ;
;
故答案为:13.5。


科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。
 ,下列说法正确的是( )
,下列说法正确的是( )
A. NaOH溶液可以用氨水来代替
B. 溶液a中含有Al3+、K+、Cl-、Na+、OH-
C. 溶液b中只含有NaCl
D. 向溶液a中滴加盐酸需控制溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子数目的对应关系,完全正确的是( )
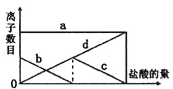
A. a:K+; b:HCO3—;c:CO32—;d:Cl—
B. a:K+; b:CO32—;c:HCO3—;d:Cl—
C. a:K+; b:CO32—;c:Cl—;d:HCO3—
D. a:K+; b:HCO3—;c:Cl—;d:CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的含量是空气质量日报中一项重要检测指标,也是最近雾霾天气肆虐我国大部分地区的主要原因之一。加大SO2的处理力度,是治理环境污染的当务之急。
I.电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如右图所示(电极均为惰性材料):

(1)M极发生的电极反应式为________________。
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为________L(已知:1个e-所带电量为1.6×10-19C)。
Ⅱ.溶液与电化学综合(钠碱循环法)处理SO2。
(3)钠碱循环法中,用Na2SO3溶液作为吸收液来吸收SO2,该反应的离子方程式为______________。
(4)吸收液吸收SO2的过程中,pH随n(SO32-)/n(HSO3-)变化关系如右图所示:
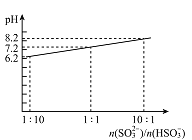
①用图中数据和变化规律说明NaHSO3溶液呈酸性的原因________________。
②n(SO32-)/n(HSO3-)=1:1时,溶液中离子浓度由大到小的顺序是_____________。
(5)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,其电解示意图如下:
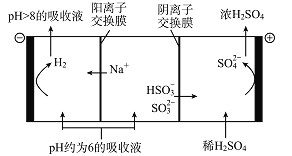
①写出阳极发生的电极反应式________________;
②当电极上有2 mol电子转移时阴极产物的质量为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]() ,下图中的曲线是不同温度下的平衡转化率曲线,图中有a、b、c三点,则下列说法正确的是
,下图中的曲线是不同温度下的平衡转化率曲线,图中有a、b、c三点,则下列说法正确的是
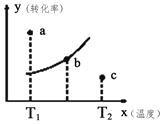
A.该反应是放热反应
B.b点时有![]()
C.![]() 温度下,若由a点达到平衡,可以采取增大压强的方法
温度下,若由a点达到平衡,可以采取增大压强的方法
D.c点![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物:
①NaCl;②NaOH;③HCl;④NH4Cl;⑤CH3COONa;⑥CH3COOH;⑦NH3·H2O;⑧H2O
回答下列问题。
(1)NH4Cl溶液显 性,用离子方程式表示原因 ,其溶液中离子浓度大小顺序为 。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)= ,在pH=3的CH3COOH溶液中,水电离出来的c(H+)= 。
(3)已知纯水中存在如下平衡:H2O+H2O![]() H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是 (填字母序号)。
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是 (填字母序号)。
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100 ℃[其中c(H+)=1×10-6 mol·L-1]
D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m (填“<”、“>”或“=”)n。
(5)除⑧H2O外,若其余7种物质的溶液的物质的量浓度相同,则这7种物质的溶液按pH由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,2SO2+O2![]() 2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是
2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
B.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零
C.如果反应前充入由18O原子组成的O2,反应达到平衡状态时,18O只存在于O2和SO3中
D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在漂白液(次氯酸钠溶液)中:Ag+、K+、NO3-、SO32-
B.中性溶液:K+、NO3-、Br-、Fe3+
C.![]() =1012的溶液中,NH4+、Ca2+、Cl-、NO3-
=1012的溶液中,NH4+、Ca2+、Cl-、NO3-
D.由水电离的c(H+)=1×10-10mol/L的溶液中:K+、Na+、HCO3-、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL一定浓度的HCOOH溶液中不断滴加1mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lgc水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是( )

A.常温下,Ka(HCOOH)的数量级为10-4
B.a、b两点的pH均为7
C.从a点到b点,水的电离程度先增大后减小
D.混合溶液的导电性逐渐增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com