
【题目】对可逆反应![]() ,下列叙述正确的是
,下列叙述正确的是
A.达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减少
B.化学反应速率关系是:![]()
C.达到化学平衡时,![]()
D.若单位时间内生成![]() 的同时,消耗
的同时,消耗![]() ,则反应达到平衡状态
,则反应达到平衡状态
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】为探究Fe3+和Cu2+对H2O2分解反应的催化效果,某同学分别设计了图1、图2所示的实验。下列叙述中不正确的是( )

A.图2中的A为分液漏斗
B.图2实验可通过测定相同状况下产生的气体体积与反应时间来比较反应速率
C.若图1实验中反应速率为①>②,则Fe3+对H2O2分解的催化效果一定比Cu2+好
D.图1实验可通过观察产生气泡的快慢来比较反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.相同条件下,测得![]() 溶液的pH大于相同物质的量浓度的
溶液的pH大于相同物质的量浓度的![]() 溶液,说明非金属性:
溶液,说明非金属性:![]()
B.绝热容器中,向50mL1![]() 的盐酸中加入烧碱,水的
的盐酸中加入烧碱,水的![]() 不变
不变
C.相同温度时,![]() 分别在相同物质的量浓度的
分别在相同物质的量浓度的![]() 溶液和
溶液和![]() 溶液中的溶解度相同
溶液中的溶解度相同
D.有HX和HY两种弱酸且酸性![]() ,则物质的量浓度相同的NaX和NaY两溶液等体积混合的溶液中有
,则物质的量浓度相同的NaX和NaY两溶液等体积混合的溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HF的电离常数Ka=6.61×10-4,NH3﹒H2O电离常数Kb=1.78×10-5。下列说法正确的是
A.NH4F溶液中![]()
B.NH4F溶液中水的电离程度小于纯水的电离程度
C.NH4F溶液中F-的水解平衡常数Kh(F-)=1.51×10-11
D.NH4F与NH4Cl的混合溶液中有下列关系:c(NH4+)>c(F-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物:
①NaCl;②NaOH;③HCl;④NH4Cl;⑤CH3COONa;⑥CH3COOH;⑦NH3·H2O;⑧H2O
回答下列问题。
(1)NH4Cl溶液显 性,用离子方程式表示原因 ,其溶液中离子浓度大小顺序为 。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)= ,在pH=3的CH3COOH溶液中,水电离出来的c(H+)= 。
(3)已知纯水中存在如下平衡:H2O+H2O![]() H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是 (填字母序号)。
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是 (填字母序号)。
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100 ℃[其中c(H+)=1×10-6 mol·L-1]
D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m (填“<”、“>”或“=”)n。
(5)除⑧H2O外,若其余7种物质的溶液的物质的量浓度相同,则这7种物质的溶液按pH由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列化学平衡在一定条件下发生移动的描述,不正确的是
A.Cl2+H2O![]() HCl+HClO,氯水中加入碳酸钙,漂白性增强
HCl+HClO,氯水中加入碳酸钙,漂白性增强
B.ZnS + Cu2+![]() CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
C.2NO2![]() N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
D.Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的电池反应为:![]()
![]()
![]()
![]() 下列说法正确的是
下列说法正确的是
A.放电时,正极的反应式是:![]()
B.放电时,电解质溶液中的H+向负极移动
C.充电时,阳极的电极反应为:![]()
D.充电时,当有20.7gPb生成时,转移的电子为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如图。下列说法不正确的是

A.点①和点②所示溶液中:c(CH3COO-)>c(CN-)
B.点④所示溶液中:c(Na+)>c(CH3COO-) >c(OH-)>c(H+)
C.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D.点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。其中,控制空气中氮氧化物和硫氧化物的含量尤为重要。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H= -867.0kJ/mol;
②N2(g)+2O2(g)=2NO2(g) △H=+67.8kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0kJ/mol
则CH4催化还原NO的热化学方程式为_______。
(2)将0.20mol NO和0.10mol CO充入一个温度恒定、容积恒为2L的密闭容器中发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g),可实现氮氧化物的转化,反应过程中部分物质的物质的量变化如图所示。
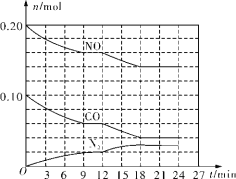
①N2在0~9min内的平均反应速率v(N2)=________mol/(L·min)(保留两位有效数字)。
②第12min时改变的反应条件可能为________(填字母代号)。
a.充入水蒸气稀释反应物 b.加入NO c.加催化剂 d.增大压强
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中![]() =_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
=_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): ___________
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+) =c(SO32-)+c(HSO3-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com