
绿矾(FeSO4·7H2O)可用于色谱分析剂、净水、照相制版等方面。下面是以铁屑(含少量锡等杂质)生产绿矾的一种方法: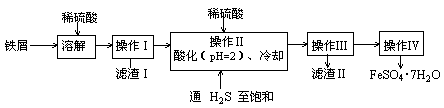
己知:在H2S饱和溶液中,SnS沉淀完全时的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时溶液的pH为5.5。
(1)操作Ⅱ中用pH试纸测定溶液pH的操作是:
(2)操作Ⅱ中用硫酸酸化至pH=2的目的是
(3)操作Ⅲ中需要的玻璃仪器是烧杯、 。
(4)通入硫化氢至饱和的目的是:①除去操作Ⅰ所得溶液中含有的Sn2+等杂质离子;
②
(5)操作IV的顺序依次为: 、冷却结晶、 。
(6)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;② 。
(1)将pH试纸放在干净、干燥的表面皿上,用干净、干燥的玻璃棒蘸取少量待测液滴在pH试纸中间,观察颜色并与比色卡比较
(2)使溶液中的Sn2+完全转化为SnS,而Fe2+不生成FeS沉淀
(3)玻璃棒、漏斗
(4)将溶液中的Fe3+离子转化为Fe2+离子
(5)蒸发浓缩 过滤 (6)降低绿矾的溶解度,减少绿矾的损失
解析试题分析:工艺流程题的关键是搞清楚加入什么物质,发生什么反应,如何分离。开始铁屑(Sn)加入硫酸溶解,转化为FeSO4、SnSO4等和不溶性杂质,通过过滤的方法将不溶性杂质除去;然后根据已知条件可知,调节pH在1.6~3.0,锡转化为SnS沉淀,而Fe2+在溶液中,从而通过过滤方法进行分离;FeSO4溶液,通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到FeSO4·7H2O晶体。
考点:本题以工艺流程为基础,考查元素及化合物性质、化学实验基本操作等相关知识。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:实验题
化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题: 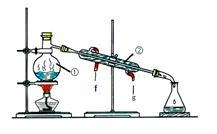
I II
(1)写出上述图中仪器的名称:① ;② ;
(2)若利用装置I分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有 ,将仪器补充完整后进行的实验操作的名称为 ;实验时仪器②中冷却水的进口为 (选填“ f ” 或 “g ” )。
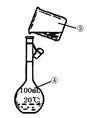
(3)现需配制250 mL 0.2 mol·L-1 NaCl溶液,装置II是某同学转移溶液的示意图,图中有两处错误分别是 , 。
(4)下列操作,使所配溶液浓度偏小的是 (填序号)。
①烧杯中NaOH溶液移入容量瓶后没有洗涤烧杯
②定容后摇匀,发现液面低于刻度线,再滴加蒸馏水至刻度线
③实验用的容量瓶洗净后未干燥,里面含有少量水
④定容时俯视
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
现有含CaO杂质的CaC2试样。某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度。请填写下列空白:
(1)第一种方案:请从下图中选用适当的装置,设计一个实验,测定CaC2试样的纯度。
所选用装置的连接顺序为(填各接口的字母): 。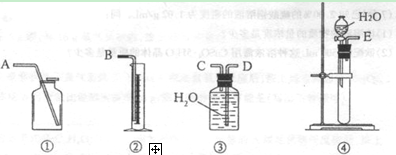
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数。先称取试样1.50g,并称量锥形瓶和水的质量为195.00g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表。
| | 读数次数 | 质量/g |
| 锥形瓶+水+试样 | 第1次 | 196.30 |
| 第2次 | 196.15 | |
| 第3次 | 196.05 | |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下: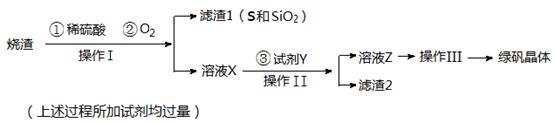 试回答:
试回答:
(1)操作Ⅰ为 (填写操作名称)。
(2) 试剂Y与溶液X反应的离子方程式为 。
(3)检验所得绿矾晶体中含有Fe2+的实验操作是 。
(4)操作Ⅲ的顺序依次为: 、冷却结晶、过滤 、 、干燥。
(5)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需 。
②该同学设计的下列滴定方式,最合理的是 (夹持部分略去)(填字母序号)。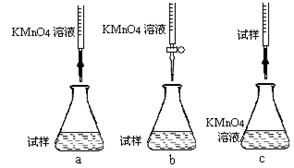
③滴定时发生反应的离子方程式为: 。
④判断此滴定实验达到终点的方法是 ;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果 (填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学小组的同学将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计了如下制备硫酸铜和硫酸铝晶体的方案: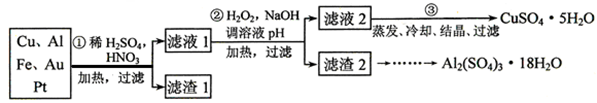
回答下列问题:
(1)第①步参加反应的金属有 种。
(2)第②步加入H2O2是因为滤液1中含有 离子。使用H2O2的优点是 。
(3) 用第③步所得CuSO4·5H2O制备无水硫酸铜的方法是: 。
(4)请帮助化学小组的同学完成由滤渣2制取Al2(SO4)3·18H2O 的实验步骤:
①取滤渣2,加入足量的 ,充分反应后过滤;
②取滤液,加入足量的 (填写试剂的化学式),然后 (填写所需实验操作的名称);
(3)用适量稀硫酸溶解;
(4)最后经过 (填写所需实验操作的名称),获得Al2(SO4)3·18H2O晶体。
(1)第③步所得CuSO4·5H2O含有可溶性杂质Na2SO4。为了用重量法测定CuSO4·5H2O的纯度,选用BaCl2(aq)和其他必要的试剂,请列出必须测定的物理量 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式 。
(2)实验装置(如图所示)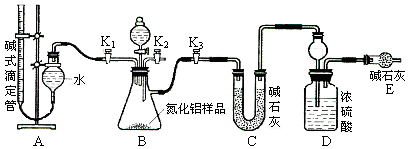
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL。
②称取xg AlN样品置于锥形瓶中;塞好胶塞,关闭活塞 ,打开活塞 ,通过分液漏斗加入稀硫酸,与烧瓶内物质充分反应。
③待反应进行完全后,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量 (填化学式),与烧瓶内物质充分反应。
④ (填入该步应进行的操作)。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析
①AlN的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响”)。
③Al4C3的质量分数为 。(该实验条件下的气体摩尔体积为Vm)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
化学实验是研究物质性质的基础。
(1)下列有关实验操作或测量数据合理的是________(填序号)。
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
(2)某废水样品中含有一定量的Na+、CO32-、SO32-,某研究小组欲测定其中SO32-的浓度。
实验方案:
ⅰ.用烧杯盛取废水适量,加少量活性炭,除去废水中的杂质;过滤,取滤液;
ⅱ.精确量取20.00 mL过滤后废水试样,选择使用紫色的0.1 mol/L KMnO4(H2SO4酸化)溶液进行滴定;
ⅲ.记录数据,计算。
①下列滴定方式中,最合理的是(夹持部已分略去)______(填字母序号)。
②滴定过程中,有关反应的离子方程式是__________________________________。
(3)某同学制备Fe(OH)3胶体:用洁净的烧杯取适量蒸馏水加热至沸腾,向烧杯中滴加 1 mol/L的FeCl3溶液,并不断用玻璃棒搅拌,结果溶液变浑浊。该同学制备胶体失败的原因是 ,你认为成功制得Fe(OH)3胶体的特征现象是_________。
(4)用下图装置进行CO2性质的有关实验。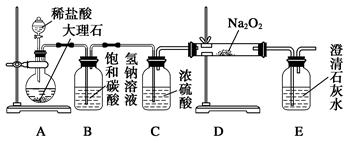
试剂瓶B中盛有饱和NaHCO3溶液,其目的是:
_______________________ __________。
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系:
____________________ ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验能达到目的的是
| A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
| B.将NH4Cl溶液蒸干制备NH4Cl固体 |
| C.用可见光束照射以区别溶液和胶体 |
| D.用萃取分液的方法除去酒精中的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列除杂质的方法中正确的是( )
| A.乙醇中混有乙酸,加入NaOH溶液后,用分液漏斗分液 |
| B.乙烷中混有乙烯,通入H2,在一定条件下反应使乙烯完全转化成乙烷 |
| C.苯甲醛中混有苯甲酸,加入生石灰后,再加热蒸馏 |
| D.溴苯中含有单质溴加入KI溶液后用分液漏斗分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com