
【题目】甘氨酸亚铁络合物[化学式为(NH2CH2COO)2Fe]是常用的补铁剂,其合成方法如下: 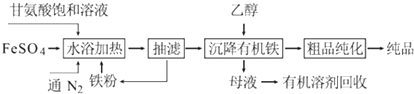
(1)通入N2的作用是 .
(2)已知甘氨酸显弱酸性,其结构简式为NH2CH2COOH,甘氨酸亚铁络合物易溶于水且在水中难电离,写出“水浴加热”过程中生成甘氨酸亚铁络合物的反应的离子方程式
(3)抽滤的好处是 , 从“母液”中回收有机溶剂的方法是 .
(4)“粗品纯化”的操作为蒸馏水洗涤、洗涤、干燥,其中干燥过程使用的设备最好选用(填“常压干燥机”或“真空干燥机”).
(5)有文献指出,若在“水浴加热”过程中投入适量的石灰石,则能同时提高产品的产率和纯度,请解释原因: .
(6)若甘氨酸的投料量为300kg,产出纯品346.8kg,则产率为 . (甘氨酸的相对分子质量为75)
【答案】
(1)防止Fe2+被氧气氧化或搅拌以加快化学反应速率
(2)2NH2CH2COOH+Fe=(NH2CH2COO)2Fe+H2↑,NH2CH2COOH+Fe2+?(NH2CH2COO)2Fe+2H+
(3)加快过滤的速度;蒸馏
(4)无水乙醇(或丙酮等);真空干燥机
(5)石灰石消耗H+ , 使H+浓度降低,有利于反应向生成甘氨酸亚铁络合物的方向进行;同时,Ca2+与SO42﹣反应生成CaSO4沉淀,降低了杂质离子SO42﹣的浓度
(6)85%
【解析】解:(1)甘氨酸饱和溶液通入氮气,气流通过溶液,能起搅拌溶液的作用,搅拌以加快化学反应速率,水浴加热甘氨酸饱和溶液和硫酸亚铁的混合物,亚铁离子易被氧气氧化,氮气为保护气,通入氮气,防止Fe2+被氧气氧化, 所以答案是:防止Fe2+被氧气氧化或搅拌以加快化学反应速率;(2)甘氨酸显弱酸性,加入铁粉2NH2CH2COOH+Fe=(NH2CH2COO)2Fe+H2↑,水浴加热甘氨酸饱和溶液和硫酸亚铁的混合物,离子反应为:2NH2CH2COOH+Fe2+(NH2CH2COO)2Fe+2H+ ,
所以答案是:2NH2CH2COOH+Fe=(NH2CH2COO)2Fe+H2↑;2NH2CH2COOH+Fe2+(NH2CH2COO)2Fe+2H+;(3)抽滤是指用抽气泵使瓶中的压强降低,达到固液分离的目的,能加快过滤的速度,互溶的液体采用蒸馏的方法分离,所以采用蒸馏的方法从母液中回收有机物,
所以答案是:加快过滤的速度;蒸馏;(4)甘氨酸亚铁络合物[化学式为(NH2CH2COO)2Fe]为有机络合物,粗品纯化采用无水乙醇(或丙酮等)洗涤,有机物的沸点较低,采用真空干燥机能实现在低温条件下加热脱水干燥,所以选择真空干燥机干燥,
所以答案是:无水乙醇(或丙酮等);真空干燥机;(5)甘氨酸显弱酸性,其结构简式为NH2CH2COOH,投入适量的石灰石,石灰石消耗H+ , 使H+浓度降低,有利于反应2NH2CH2COOH+Fe2+(NH2CH2COO)2Fe+2H+ , 向生成甘氨酸亚铁络合物的方向进行,同时,Ca2+与SO42﹣反应生成CaSO4沉淀,降低了杂质离子SO42﹣的浓度,
所以答案是:石灰石消耗H+ , 使H+浓度降低,有利于反应向生成甘氨酸亚铁络合物的方向进行,同时,Ca2+与SO42﹣反应生成CaSO4沉淀,降低了杂质离子SO42﹣的浓度;(6)甘氨酸的投料量为300kg,甘氨酸的物质的量n= ![]() =4×103mol,生成n[(NH2CH2COO)2Fe]=2×103mol,产率为=
=4×103mol,生成n[(NH2CH2COO)2Fe]=2×103mol,产率为= ![]() ×100%=
×100%= ![]() =85%,
=85%,
所以答案是:85%.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:
【题目】EHPB是合成治疗高血压和充血性心力衰竭的药物的中间体,合成路线如下: 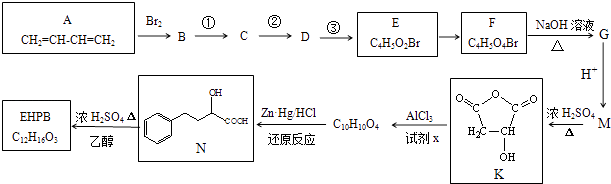
已知:
ⅰ碳碳双键容易被氧化
ⅱ ![]() +Cl2
+Cl2![]()
![]()
![]()
![]()
ⅲ ![]()
(1)A的名称是 , A形成的顺丁橡胶的结构式是(选填字母). 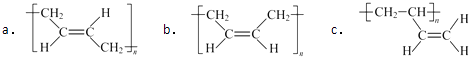
(2)已知1molE发生银镜反应可生成4molAg.E中含氧官能团的名称为 .
(3)E由B经①、②、③合成.
a.①的反应试剂和条件是 .
b.②、③的反应类型依次是、 .
(4)1molF转化成G所消耗的NaOH的物质的量为mol.
(5)M的结构简式为 .
(6)完成下列化学方程式:
①EHPB不能与NaHCO3反应,有机物N→EHPB的化学方程式为
②有机物K与试剂x发生反应的化学方程式为 .
(7)有机物N有多种同分异构体,写出一种满足下列条件的同分异构体的结构简式 .
a.含有酚羟基 b.既能水解又能发生银镜反应
c.苯环上的一氯代物只有一种 d.核磁共振氢谱有5组峰.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4 、较多的Cu2+ 、H+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。其一种生产工艺如下:
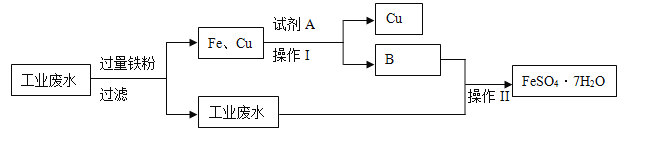
回答下列问题:
(1)写出工业废水中加入过量铁粉发生化学反应离子方程式,并用“单线桥”表示电子转
移方向和数目_________________________。
(2)试剂A化学式___________;生成物B化学式__________。
(3)操作I的名称________,操作II的名称______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提纯下列物质(括号内为少量杂质),所选用的除杂试剂与分离方法正确的是( )
不纯物质 | 除杂试剂 | 分离方法 | |
A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
C | 苯(Br2) | KOH溶液 | 分液 |
D | 苯(苯酚) | 浓溴水 | 过滤 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的乙烷完全燃烧,使所有的气体按顺序通过装有无水氯化钙和氢氧化钾的硬质玻璃管,氢氧化钾管的质量增加了4.4g,则乙烷在标准状况下体积( )
A.0.56L
B.1.12L
C.2.24L
D.3.36L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素和硼族元素在生产生活中有很重要的地位.
(1)写出硼族元素Ga的基态原子核外电子排布式
(2)NF3的分子构型为 , NO3﹣的空间构型为 , 1mol NO3﹣中含有的σ键的数目为: .
(3)氮化硼的立方结晶的变体被认为是已知的最硬的物质.BN的晶体结构与金刚石相似,其中B原子的杂化方式为
(4)元素第一电离能的大小:As(填“<”“>”或“=”)Ga,原因是 .
(5)相同条件下,在水中的溶解度:NH3(填“<”“>”或“=”)PH3 , 原因是 .
(6)已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm.则砷化镓的化学式为 , 晶胞中As原子和它最近的Ga原子之间的距离为pm(用含c的式子表示),砷化镓的密度为gcm﹣3(设NA为阿伏伽德罗常数的值,用含c、NA的式子表示,原子量:Ga﹣70,As﹣75). 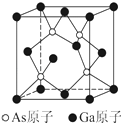
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4gNaOH和10.6gNa2CO3混合并配成溶液,向溶液中滴加0.1mol﹒L﹣1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. 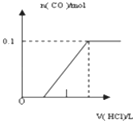 B.
B. 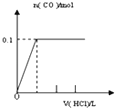
C. 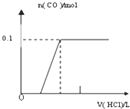 D.
D. 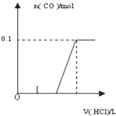
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个体重50kg的健康人体内含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。请回答下列问题:
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是________________。
A .Fe B.Fe2+ C.Fe3+
(2)维生素C可使食物中的Fe3+转化为Fe2+,在此过程中__________是氧化剂,说明维生素C具有____性。
(3)己知下列反应: ①2I-+2Fe3+=2Fe2+ +I2 ②2Fe2++H2O2+2H+=2Fe3++2H2O, 则Fe3+ 、I2 、H2O2三者的氧化性由强到弱为____________________________。
(4)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中, HNO3表现的性质为_______ ,毎有1 molFe参加反应转移电子_____________mol。
(5)用双线桥标出该反应Fe+4HNO3=Fe(NO3)3+NO↑+2H2O电子转移的数目和方向______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥运场馆 “水立方” 顶部和外部使用了一种新型膜材料,它与制作塑料袋的材料类型相同,都属于
A. 光导纤维B. 有机合成材料C. 金属材料D. 玻璃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com