
【题目】下列说法正确的是
A.硼的电负性和硅相近
B.π键是由两个p轨道“肩并肩”重叠形成的,呈轴对称。
C.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的
D.原子和其它原子形成共价键时,其共价键数一定等于原子的价电子数
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水,稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4反应的化学方程式为:CuCl(s)+3HCl(aq)![]() H3CuCl4(aq)。
H3CuCl4(aq)。
Ⅰ.实验室用图所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl+2H2O=2CuCl43+SO42+4H+
CuCl43(aq)![]() CuCl(s)+3Cl-(aq)
CuCl(s)+3Cl-(aq)

⑴装置A中分液漏斗中的试剂应该是____________。
A.稀硫酸 B.98%的硫酸 C.65%的硫酸
⑵装置B中反应结束后,取出混合物进行如下图所示操作,得到CuCl晶体。
![]()
操作ⅱ的主要目的是_______;操作ⅳ中宜选用的试剂是____________。
⑶实验室保存新制CuCl晶体的方法是___________________________。
⑷欲提纯某混有铜粉的CuCl晶体,请简述实验方案_______________。
Ⅱ.某同学利用如图所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。

已知:①CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O。
②保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
(5)为了确保实验正确性,D、E、F、G测定气体顺序应该为________________。
(6)写出保险粉和KOH的混合溶液吸收O2的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。 下列叙述错误的是( )
A.还原铁粉能用作食品抗氧化剂
B.“日照遂州江雾开”中伴有丁达尔效应
C.浸泡过KMnO4溶液的硅土可作水果保鲜剂
D.河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以饮用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学反应原理回答下列问题:
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.

①该反应的焓变△H__0.(填“>”或“<”)
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为______.
③T1温度下该反应的化学平衡常数K1=______.
(2)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图所示,则阴极的电极反应式是____________.

(3)已知某些弱电解质在水中的电离平衡常数(25℃)如表:
弱电解质 | H2CO3 | NH3H2O |
电离平衡常数 | Ka1=4.30×10﹣7 Ka2=5.61×10﹣11 | Kb=1.77×10﹣5 |
现有常温下0.1molL﹣1的(NH4)2CO3溶液,
①该溶液呈__性(填“酸”、“中”、“碱”),原因是___________.
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是__.
A.c(NH4+)>c(CO32﹣)>c(HCO3﹣)>c(NH3H2O)
B.c(NH4+)+c(H+)=c(HCO3﹣)+c(OH﹣)+c(CO32﹣)
C.c(CO32﹣)+c(HCO3﹣)+c(H2CO3)=0.1mol/L
D.c(NH4+)+c(NH3H2O)=2c(CO32﹣)+2c(HCO3﹣)+2c(H2CO3)
E.c(H+)+c(HCO3﹣)+c(H2CO3)=c(OH﹣)+c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:

(1)密闭容器的体积是_____L;
(2)若t1=15时,则t0~t1 s内以C物质浓度变化表示的反应速率v(C)=_______;
(3)写出反应的化学方程式:________________________;
(4)t1 s时,A的转化率为__________,此时v(A)正______v(B)逆(选填“>”、“<”或“=”);
(5)B的起始的物质的量是_____;
(6)平衡时体系内的压强为初始状态的___________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
A. 降低温度 B. 缩小体积使压强增大
C. 升高温度同时充入N2 D. 及时将CO2和N2从反应体系中移走
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列以下有关酶的问题:
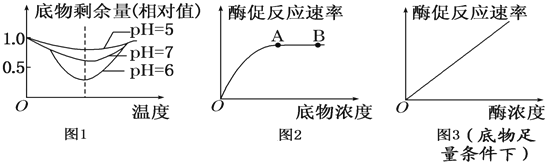
(1)由图1曲线可知:当pH从5上升到7,酶活性的变化过程是 ;从图示曲线还可以得出的结论是 .
(2)图2和图3是底物浓度和酶浓度对酶促反应的影响曲线,请分析回答:
图2中A点后酶促反应的速率不再增加,其限制性因素主要是 .从图3可以得出的结论是:在底物足量的条件下, .
(3)以下是一个有关酶的实验,根据表格内容分析回答下列问题:
操作步骤 | 操作方法 | 试管A | 试管B | 试管C |
1 | 加淀粉溶液 | 2mL | 2mL | 2mL |
2 | 加淀粉酶溶液 | 1mL | 1mL | 1mL |
3 | 温度处理 | 60℃ | 100℃ | 0℃ |
4 | 加碘液 | 2滴 | 2滴 | 2滴 |
①表中为探究 的实验.
②请指出实验操作步骤存在的问题 .
③该实验把温度处理改为pH分别为5、7、9能否用于探究pH对酶活性的影响? 说明理由 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com