
【题目】KClO3热分解是实验室制取氧气的一种方法,1molKClO3(s)热分解的能量变化如图所示。实验测得第一放热温度为400℃,第二放热温度为480℃。下列说法正确的是( )
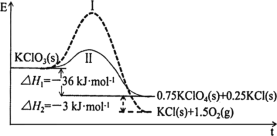
A.400℃时KClO3热分解的产物是KCl和O2
B.若用MnO2作催化剂,KClO3热分解温度大于480℃
C.曲线Ⅰ的活化能大于曲线Ⅱ,所以KClO3比KClO4稳定
D.2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78kJ·mol1
【答案】D
【解析】
根据图示,反应Ⅰ的活化能大于反应Ⅱ,所以反应Ⅰ为480℃时的反应,反应Ⅱ为400℃时的反应。
A. 反应Ⅰ为480℃时的反应,480℃时KClO3热分解的产物是KCl和O2,故A错误;
B. 催化剂降低反应的活化能,若用MnO2作催化剂,KClO3热分解温度小于480℃,故B错误;
C. 能量越低越稳定,KClO3的能量大于KClO4,所以KClO4比KClO3稳定,故C错误;
D.根据图示,1mol KClO3(s)生成1molKCl(s)和1.5molO2(g)放热36+3=39kJ,所以2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78kJ·mol1,故D正确。


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】一块11.0 g的铁铝合金,加入一定量的稀硫酸后合金完全溶解,然后加H2O2到溶液中无Fe2+存在,加热除去多余的H2O2,当加入200 mL 6 molL﹣1NaOH溶液时沉淀量最多,且所得沉淀质量为26.3 g,下列说法不正确的是
A.该合金中铁的质量为5.6 g
B.合金与稀硫酸反应共生成0.45 mol H2
C.该合金与足量氢氧化钠反应,转移的电子数为0.6 NA
D.所加的稀硫酸中含0.6 mol H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)![]() CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
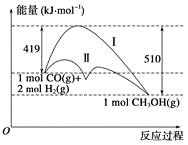
A.该反应的ΔH=+91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】㈠用系统命法写出下列物质名称:
(1)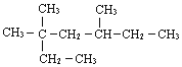 ______
______
(2)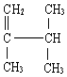 ______
______
(3)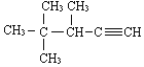 的系统名称为 ______
的系统名称为 ______
(4)键线式![]() 表示的分子式 ______ ,名称是 ______ .
表示的分子式 ______ ,名称是 ______ .
㈡判断同分异构体的种类(不考虑立体异构):
(1)某烷烃的相对分子质量为114且分子中含有两个相同的支链则该烷烃可能的结构共有________种;
(2)“立方烷”(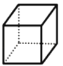 )与氯气发生取代反应生成的二氯代物共有___种;
)与氯气发生取代反应生成的二氯代物共有___种;
(3)甲苯的二氯取代物共有_____种;
(4)“金刚烷”(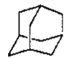 )它可看作是由四个等同的六元环组成的空间构型.请判断:
)它可看作是由四个等同的六元环组成的空间构型.请判断:
①一溴代物有____种;
②由氯原子取代金刚烷亚甲基(﹣CH2﹣)中氢原子所形的二氯取代物共有___种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种二元弱酸,可用作还原剂、沉淀剂等。某校课外小组的同学设计利用C2H2气体制取H2C2O4·2H2O。回答下列问题:
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用下图1装置制取C2H2。
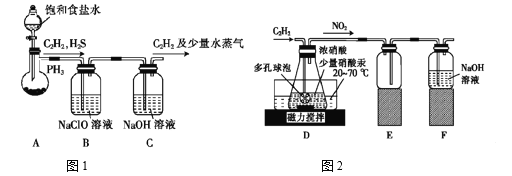
①电石与水反应很快,为了减缓反应速率,装置A中除用饱和食盐水代替水之外,还可以采取的措施是__________(写一种即可)。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为______。该过程中,可能产生新的杂质气体Cl2,其原因是: _____________(用离子方程式回答)。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如上图2所示:
①装置D中多孔球泡的作用是______________________。
②装置D中生成H2C2O4的化学方程式为____________________________。
③从装置D中得到产品,还需经过_____________(填操作名称)、过滤、洗涤及干燥。
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定终点的现象是______________________。
②滴定过程中发现褪色速率开始很慢后逐渐加快,分析可能的原因是_______________。
③产品中H2C2O4·2H2O的质量分数为_______________(列出含 m、c、V 的表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(原创)如图表示不同温度下水溶液中c(H+)与c(OH-)的关系,下列判断正确的是( )
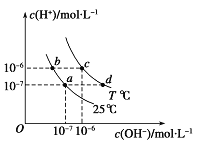
A.两条曲线上任意点均有c (H+) ×c (OH-)=Kw
B.T<25℃
C.b点和c点pH均为6,溶液呈酸性
D.只采用升温的方式,可由a点变成d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为__(用化学式表示);
(2)体积为10 mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1 000 mL,稀释后溶液的pH,前者__后者(填“>”、“<”或“=”);
(3)25℃时,pH之和为14的CH3COOH溶液与NaOH溶液混合,充分反应后溶液显中性,则所耗溶液的体积前者__后者(填“>”、“<”或“=”);
(4)若用NaOH标准溶液滴定未知浓度的醋酸,选择的指示剂应为_;
(5)下列离子CH3COO-、CO32-、HCO3-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为___;
(6)25℃时,把100mLpH为2的盐酸变为3,若分别用加入蒸馏水和加入pH为4的稀硫酸,则所需蒸馏水和pH为4的稀硫酸的体积之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
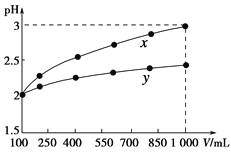
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入![]() 和
和![]() ,一定条件下使反应
,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如图所示
达到平衡,正反应速率随时间变化的示意图如图所示![]() 由图得出的结论不正确的是
由图得出的结论不正确的是
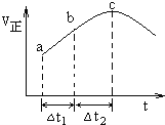
A. 反应过程中压强始终不变
B. 反应物浓度:a点大于b点
C. 反应物的总能量高于生成物的总能量
D. ![]() 时,
时,![]() 的转化率:
的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com