
【题目】相对分子质量为 M 的气态化合物 V L(标准状况),溶于 m g 水中,得到质量分数为 w、物质的量浓度为 c mol/L、密度为 ρg/mL 的溶液,下列说法正确的是
A.相对分子质量![]() B.物质的量浓度
B.物质的量浓度![]()
C.溶液的质量分数![]() D.溶液密度
D.溶液密度![]()
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加徳罗常数的值,诺贝尔物理学奖获得者让·佩兰于 1909 年提出常数命名 为阿伏加德罗常量来纪念他,下列说法正确的是
①标准状况下,11.2 L 以任意比例混合的氮气和氧气所含的原子数为 NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③2 mol/L 的氯化镁溶液中含氯离子数目为 4 NA
④标准状况下,22.4 L 水中分子数为 NA
⑤46 g NO2 和 N2O4 混合气体中含有原子数为 3 NA
A.①②⑤B.①②C.①③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有反应4HCl(g)+O2(g)═2Cl2(g)+2H2O(g),已知2 mol O2被还原时,放出a kJ的热量,且知断开1 mol O=O键需要吸收b kJ的热量,断开1 mol Cl—Cl键需要吸收c kJ的热量。则断开1 mol H—O键比断开1 mol H—Cl键所需能量高
A. (b-a-2c)/4kJB. (a+2b-4c)/8kJC. (a+b-2c)/4kJD. (2b-a-4c)/8kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,加“碘”食盐中添加较多的是碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极材料,以KI溶液为电解液,在一定条件下进行电解,反应的化学方程式为KI+3H2O![]() KIO3+3H2↑。下列有关说法不正确的是
KIO3+3H2↑。下列有关说法不正确的是
A. 加碘食盐不能使淀粉溶液变蓝
B. 电解时,石墨作阳极,不锈钢作阴极
C. 阳极的电极反应式为I-+3H2O+6e-=IO3-+6H+
D. 转移3 mol电子,理论上可制得107 g KIO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X可用于合成Y.下列有关X、Y的说法正确的是( )
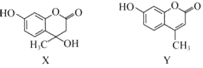
A. X分子中所有原子可能在同一平面上
B. X在一定条件下可以发生消去反应
C. Y与足量H2的加成产物中不含手性碳原子
D. X、Y与足量浓溴水反应的类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液。他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了。原因是(用离子方程式和简要文字说明表示)___________________________,最后,他向烧杯中加入了一定量的_________________溶液,得到了澄清的CuSO4溶液。
(2)该同学利用制得的CuSO4溶液,进行了以下实验探究。
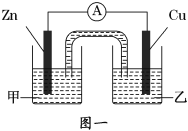
①图一是根据反应Zn+CuSO4═Cu+ZnSO4设计成的锌铜原电池。电解质溶液乙是______溶液,Cu极的电极反应式是____________________。
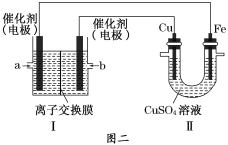
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为NaOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则Fe电极为__________(填“阳极”或“阴极”)。若铜电极的质量减轻3.2 g,则消耗的CH4在标准状况下的体积为___________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用氯气.
I.工业上通常采用电解法制氯气:观察下图,回答:
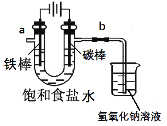
(1)电解反应的化学方程式为____________________。
(2)饱和食盐水通电后,b端产生的气体检验方法是____________。
II. 实验室用NaOH固体配制100 mL 1.0 mol·L-1的NaOH溶液,试回答下列各题:
(3)需要用托盘天平称量_______g NaOH固体;
(4)实验室有下列仪器:①漏斗 ②200mL容量瓶 ③烧杯 ④玻璃棒 ⑤药匙 ⑥托盘天平 ⑦冷凝。若要实施溶液配制,尚缺的玻璃仪器是___________、________;
(5)容量瓶在使用前必须先____________;
(6)配制过程有以下操作: ①称量 ②移液 ③冷却 ④洗涤 ⑤定容 ⑥溶解 ⑦摇匀 其正确的操作顺序应是:① →_________→________ →________ →________→________→ ⑦
(7)下列五项操作中会导致所得溶液浓度偏低的有____________(填序号);
①没有洗涤烧杯内壁和玻璃棒
②未冷却到室温就将溶液转移到容量瓶并定容
③在转移过程中有溶液撒在外面
④定容时观察液面时俯视
⑤定容后,把容量瓶反复摇匀后发现液面低于刻度线,便滴加几滴水至刻度处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中:①SO2 ②液态氯化氢 ③CH4 ④熔融NaOH ⑤NH4Cl固体 ⑥氨水。能导电的是__________(填序号,下同)。属于电解质的是__________。属于非电解质的是__________。
(2)1.204×1024个H2SO4分子的物质的量为__________mol,共含__________个氢原子。将上述H2SO4溶于水配成600 mL溶液,再加水稀释到1000 mL,稀释后溶液的物质的量浓度为__________mol/L。
(3)K2SO4和Fe2(SO4)3的混合溶液,已知其中Fe3+的浓度为0.5mol/L,SO42-浓度为0.9mol/L,则K+的物质的量浓度为__________mol/L。
(4)有以下四种物质:① 标准状况下11.2 L CO2 ② 5 g H2 ③ 1.204×1024个N2分子 ④ 18 g H2O,其中质量最大的是____(填序号),在常温常压下体积最大的是___(填序号)。
(5)标准状况下11.2 L由CH4、N2组成的混和气体的质量为10 g,该混合气体中CH4与N2的分子数之比为_________。
(6)将标准状况下336 L HCl气体完全溶于1 L水中,所得溶液的密度为 ρ g/cm3,则该溶液的物质的量浓度为_____ mol/L(计算结果中的数字保留整数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com