
分析 (1)根据稀释定律,稀释前后溶质的物质的量不变,据此计算混合溶液中CuSO4的物质的量浓度;
(2)混合后溶液中c(H+)=2c(H2SO4)、c(Cu2+)=c(CuSO4),溶液中硫酸根来源于硫酸铜与硫酸电离,故 c(SO42-)═c(CuSO4)+c(H2SO4);
(3)混合液中加入铁粉后,铜离子优先反应,根据铜离子的物质的量利用差量法计算出溶液增加的质量;若要使溶液质量不变,则氢离子与铁反应使溶液增加的质量一定与铜离子与铁反应时溶液增加的质量,据此计算出消耗铁粉的总质量.
解答 解:(1)把1L 1.0mol/LCuSO4和1L 0.5mol/LH2SO4溶液混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)=$\frac{1.0mol/L×1L}{2L}$=0.5 mol/L,
答:混合液中CuSO4 的物质的量浓度为0.5mol/L;
(2)混合液中硫酸的浓度为:c(H2SO4)=$\frac{0.5mol/L×1L}{2L}$=0.25mol/L,混合后溶液中的c(H+)=2c(H2SO4)=2×0.25mol/L=0.5mol/L;
溶液中硫酸根离子来源于硫酸铜与硫酸电离,则c(SO42-)═c(CuSO4)+c(H2SO4)=0.5mol/L+0.25mol/L=0.75mol/L,
答:混合后溶液中c(H+)=0.5mol/L,c(SO42-)=0.75mol/L;
(3)向混合液中加入铁粉后,铜离子优先反应,混合液中含有铜离子的物质的量为:n(Cu2+)=0.5mol/L×2L=1mol,
则铜离子与铁完全反应使溶液增加的质量为:
Fe~Cu~△m,
1mol 1mol 8g
n(Fe)1mol m
m=8g,消耗的Fe为1mol,质量为:56g/mol×1mol=56g;
若要使溶液质量不变,则铁与氢离子反应中使溶液减少的质量为8g,
Fe~H2~△m
56 2 54
m(Fe) 8g
需要氢离子消耗的铁的质量为:m(Fe)=$\frac{56×8g}{54}$≈8.3g,
所以总共消耗铁的质量为:56g+8.3g=64.3g,
答:向混合溶液中加入64.3g铁粉,可以使溶液质量保持不变.
点评 本题考查物质的量浓度的有关计算,题目难度中等,注意对公式的理解与灵活运用,注意理解稀释定律,(3)注意利用差量法进行计算,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 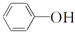 与 与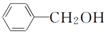 是同系物 是同系物 | |
| B. | 乙酸乙酯(CH3COOCH2CH3)的核磁共振氢谱出现三组峰,且峰面积之比为3:2:3 | |
| C. | 分子式为C4H10的有机物一氯代物共有8种 | |
| D. | 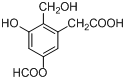 含氧官能团有4种 含氧官能团有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{36V}$mol/L | B. | $\frac{a}{18V}$mol/L | C. | $\frac{a}{54V}$mol/L | D. | $\frac{a}{27V}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉、盐酸、碘酒和液氯都属于混合物 | |
| B. | 向煮沸的1 mol/L NaOH溶液中滴加FeCl3饱和溶液,可制备Fe(OH)3胶体 | |
| C. | 熔融氯化钠,盐酸和铜都能导电,所以都属于电解质 | |
| D. | 一束平行光线照射蛋白质溶液时,从侧面可以看到一束光亮的通路 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-6mol•L-1 | |
| B. | pH相等的①NH4C1、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③ | |
| C. | Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X/m mol | B. | 2X/3mol | C. | (X+Y)mol | D. | 2(X+Y)/3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com