
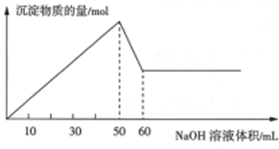
分析 在K+、Mg2+、Al3+、Fe2+、Ba2+、NH4+、NO3-、SO42-、I-、Cl-、H+,无色溶液说明无亚铁离子,①将溶液滴在pH纸上,试纸呈红色,说明溶液呈酸性,含有氢离子;②取100mL溶液加入足量铜片,收集到22.4mL(标准状况下)无色气体,该无色气体遇到空气后立即变成红棕色,最终测得溶液pH=7.若再向该反应混合物中加稀硫酸,无气体产生,说明溶液中有硝酸根离子,与足量铜反应硝酸根离子不足,所以硝酸根离子的物质的量为:10-3mol,
③取100mL溶液滴入足量氯化钡溶液,产生0.233g白色沉淀,说明溶液中含有硫酸根离子,则无钡离子,硫酸根离子的物质的量为:10-3mol,④取实验③中溶液过滤,得到澄清溶液,向其中滴入足量硝酸银溶液,生成不溶于稀硝酸的白色沉淀,说明无碘离子;⑤取100mL溶液逐滴滴入0.1mol•L-1的氢氧化钠溶液,微热,收集到44.8mL(标准状况下)有刺激性气味的气体,当溶液中无气体产生后,滴入氢氧化钠溶液过程中生成沉淀的物质的量与氢氧化钠溶液体积的关系,可知溶液中有铵根离子,铵根离子的物质的量为:2×10-3mol,由图可知有等物质的量铝离子和镁离子,而氢氧化铝完全溶解消耗氢氧化钠的物质的量为:0.1mol•L-1×10×10-3mol,所以铝离子和镁离子的物质的量各为10-3mol,⑥取100mL溶液进行焰色反应,透过蓝色钴玻璃观察不到紫色火焰,说明无钾离子,根据电荷守恒确定是否有氯离子,由此分析解答.
解答 解:在K+、Mg2+、Al3+、Fe2+、Ba2+、NH4+、NO3-、SO42-、I-、Cl-、H+,无色溶液说明无亚铁离子,①将溶液滴在pH纸上,试纸呈红色,说明溶液呈酸性,含有氢离子;②取100mL溶液加入足量铜片,收集到22.4mL(标准状况下)无色气体,该无色气体遇到空气后立即变成红棕色,最终测得溶液pH=7.若再向该反应混合物中加稀硫酸,无气体产生,说明溶液中有硝酸根离子,与足量铜反应硝酸根离子不足,所以硝酸根离子的物质的量为:10-3mol,
③取100mL溶液滴入足量氯化钡溶液,产生0.233g白色沉淀,说明溶液中含有硫酸根离子,则无钡离子,硫酸根离子的物质的量为:10-3mol,④取实验③中溶液过滤,得到澄清溶液,向其中滴入足量硝酸银溶液,生成不溶于稀硝酸的白色沉淀,说明无碘离子;⑤取100mL溶液逐滴滴入0.1mol•L-1的氢氧化钠溶液,微热,收集到44.8mL(标准状况下)有刺激性气味的气体,当溶液中无气体产生后,滴入氢氧化钠溶液过程中生成沉淀的物质的量与氢氧化钠溶液体积的关系,可知溶液中有铵根离子,铵根离子的物质的量为:2×10-3mol,由图可知有等物质的量铝离子和镁离子,而氢氧化铝完全溶解消耗氢氧化钠的物质的量为:0.1mol•L-1×10×10-3mol,所以铝离子和镁离子的物质的量各为10-3mol,⑥取100mL溶液进行焰色反应,透过蓝色钴玻璃观察不到紫色火焰,说明无钾离子,根据电荷守恒确定是否有氯离子,除氢离子外,阳离子带的正电荷的物质的量为:2×10-3mol+3×10-3mol+2×10-3mol=7×10-3mol,而阴离子带的负电荷的物质的量为:10-3mol+2×10-3mol=3×10-3mol,远小于正电荷数,所以一定含有氯离子,
(1)溶液中一定不含的离子有:K+、Fe2+、Ba2+、I-,故答案为:K+、Fe2+、Ba2+、I-;
(2)溶液中一定含有的离子物质的量浓度分别为:Mg2+和Al3+的浓度分别为:0.01mol/L,NH4+、NO3-和SO42-的浓度分别为:0.02mol/L、0.01mol/L和0.01mol/L,故答案为:c(Mg2+)=0.01mol/L、c(Al3+)=0.01mol/L,c(NH4+)=0.02mol/L,c(NO3-)=0.01mol/L,和c(SO42-)=0.01mol/L;
(3)写出实验②中生成无色气体,是铜与氢离子和硝酸离子反应生成铜离子和一氧化氮,其离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
点评 本题考查了离子检验的实验方法和反应现象分析判断,熟练掌握离子共存的条件及离子性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④⑤ | C. | ③④ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
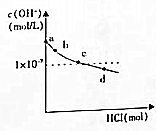
| 坐标对应点 | a | b | c | d |
| n(SO32-)n:(HSO3-) | 91:9 | 1:1 | 9:91 | |
| pH | >8.2 | 8.2 | 7.2 | 6.2 |
| A. | b点溶液中:水电离出的c(OH-)=1×10-5.8mol/L | |
| B. | c点溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) | |
| C. | d点溶液中HSO3-的电离大于水解 | |
| D. | d点溶液中:c(Na+)<c(SO32-)+c(HSO3-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ③
③ ④
④ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2HCl+Na2CO3═2NaCl+H2O+CO2↑ | B. | 2HNO3+BaCO3═Ba(NO3)2+H2O+CO2↑ | ||
| C. | H2SO4+Na2CO3═Na2SO4+H2O+CO2↑ | D. | H2SO4+(NH4)2CO3═(NH4)2SO4+H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com