

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |

分析 (1)A装置是指取二氧化碳气体的装置,是碳酸钙和盐酸发生反应生成氯化钙、水和二氧化碳;C装置稀硫酸是尾气处理装置吸收过量的氨气;
(2)B装置中的试管内是溶有氨和氯化钠的饱和溶液,通入二氧化碳气体会发生反应生成碳酸氢钠和氯化铵,温度越低越有利于碳酸氢钠的晶体析出;
(3)通入二氧化碳没有得到碳酸氢钠晶体,是二氧化碳气体中含有氯化氢气体,通入后和氨气反应不能生成碳酸氢钠,所以需要加一个洗气装置用饱和碳酸氢钠溶液除去二氧化碳中的氯化氢气体;
(4)碳酸氢钠受热分解为碳酸钠、水、二氧化碳,碳酸氢铵受热分解为氨气、水、二氧化碳,根据加热后的产物判断;
(5)测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为wg,此时为碳酸氢钠粗品质量,操作1将晶体加热到质量不再变化时,所得粉末为碳酸钠和杂质,然后溶解,加入氯化钙溶液,氯化钙跟碳酸钠反应生成碳酸钙,将生成的碳酸钙过滤、洗涤、干燥,称量为n g,根据关系式2NaHCO3--CaCO3可求出纯碳酸氢钠的质量.
①操作Ⅱ中,加入氯化钙溶液会有白色沉淀生成,当氯化钙过量时,就不会再生成沉淀;
②从溶液里得到不溶性的固体碳酸钙可选择过滤,再进行洗涤、干燥;
③根据反应过程中碳原子守恒,利用生成碳酸钙的物质的量计算样品中碳酸氢钠的质量,再计算纯度.
解答 解:(1)A装置是指取二氧化碳气体的装置,是碳酸钙和盐酸发生反应生成氯化钙、水和二氧化碳;反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O;C装置稀硫酸是尾气处理装置吸收过量的氨气,防止污染环境;
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;吸收从B装置中的试管内逸出的氨气,减少对环境的污染;
(2)B装置中的试管内是溶有氨和氯化钠的饱和溶液,通入二氧化碳气体会发生反应生成碳酸氢钠和氯化铵,依据图标分析可知温度越低,碳酸氢钠的溶解度越小,所以温度越低越有利于碳酸氢钠的晶体析出;
故答案为:温度越低碳酸氢钠溶解度越小,便于析出;
(3)二氧化碳气体中含有氯化氢气体,通入后和氨气反应不能生成碳酸氢钠,所以的不到碳酸氢钠晶体,所以需要加一个洗气装置用饱和碳酸氢钠溶液除去二氧化碳中的氯化氢气体;
故答案为:AB;饱和碳酸氢钠溶液;除去二氧化碳气体中的氯化氢气体;
(4)碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,反应为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,有白色固体碳酸钠剩余,碳酸氢铵(NH4HCO3)受热分解,生成氨气(NH3)、二氧化碳和水,反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,无固体剩余,所以判断该晶体是碳酸氢钠晶体而不是碳酸氢铵晶体,方法为:取少量晶体置于试管中,在酒精灯上加热使其充分反应后,还有白色固体剩余,则晶体不是NH4HCO3,
故答案为:取少量晶体置于试管中,在酒精灯上加热使其充分反应后,还有白色固体剩余,则晶体不是NH4HCO3;
(5)测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为wg,此时为碳酸氢钠粗品质量,操作1将晶体加热到质量不再变化时,所得粉末为碳酸钠和杂质,然后溶解,加入氯化钙溶液,氯化钙跟碳酸钠反应生成碳酸钙,将生成的碳酸钙过滤、洗涤、干燥,称量为n g,所此作答;
①为判断滴加的氯化钙溶液过量,可在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量氯化钙溶液看是否有沉淀生成,故答案为:C;
②利用过滤、洗涤、干燥可从混合液中得到不溶性的碳酸钙沉淀,故答案为:过滤;洗涤;干燥;
③反应的化学方程式为①2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O,②Na2CO3+CaCl2=CaCO3 ↓+H2O+2NaCl,得到的碳酸钙需要经过过滤、洗涤、干燥后方可称量.
设样品中碳酸氢钠的质量为x,由上两式可得关系式:
2NaHCO3--CaCO3
84×2 100
x n
$\frac{84×2}{x}=\frac{100}{n}$,x=$\frac{168n}{100}$ g,
碳酸氢钠的质量分数为$\frac{x}{w}$×100%=$\frac{\frac{168n}{100}}{w}$×100%=$\frac{168n}{w}$%,
故答案为:$\frac{168n}{w}$%.
点评 本题考查了侯氏制碱的反应原理和实验设计和操作,物质质量分数的计算,明确各原料的制备方法及尾气处理是解题的关键,难度中等,侧重对学生分析问题的能力和计算能力的考查.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
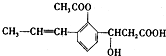 ,下列有关该有机化合物的说法不正确的是
,下列有关该有机化合物的说法不正确的是| A. | 含有四种官能团 | |
| B. | 能发生取代、加成、消去、氧化等反应• | |
| C. | 1mol该有机物最多可以与2molNaOH反应 | |
| D. | 该有机物属于芳香族化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
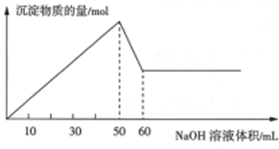
 在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )
在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )| A. | 在t℃时,AgCL的Ksp为4×10-10 | |
| B. | 在t℃时,c点溶液中一定有AgCl沉淀析出 | |
| C. | 在t℃时,AgCl的溶解度约为2.9×10-4g | |
| D. | d点溶液,温度升高后c(Ag+)、c(Cl-)均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环乙醇 | 0.96 | 25.93 | 161 | 能溶于水 |
| 环乙烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 mol NO与0.5 mol O2混合后气体的体积为22.4 L | |
| B. | 1L 0.5 mol•L-1 NaF溶液中含有的F-数目为0.5NA | |
| C. | 7.8g Na2S和Na2O2晶体混合物中共含有0.1NA个阴离子 | |
| D. | 12g石墨晶体中正六边形的数目为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com