
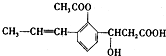
 ,下列有关该有机化合物的说法不正确的是
,下列有关该有机化合物的说法不正确的是| A. | 含有四种官能团 | |
| B. | 能发生取代、加成、消去、氧化等反应• | |
| C. | 1mol该有机物最多可以与2molNaOH反应 | |
| D. | 该有机物属于芳香族化合物 |
分析 有机物含有苯环,属于芳香族化合物,含有碳碳双键、酯基、羟基和羧基等官能团,结合烯烃、乙酸乙酯、醇以及酸的性质解答该题.
解答 解:A.含有碳碳双键、酯基、羟基和羧基等官能团,共4种,故A正确;
B.含有碳碳双键,可发生加成、氧化反应,含有羟基,可发生取代、消去反应,故B正确;
C.含有羧基和酯基,且酯基可水解生成乙酸和酚羟基,则1mol该有机物最多可以与3molNaOH反应,故C错误;
D.有机物含有苯环,属于芳香族化合物,故D正确.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酯、烯烃、酸、醇的性质及分析与应用能力的考查,题目难度不大.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
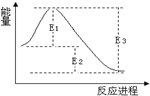
| A. | 该反应常温下一定可以自发进行 | |
| B. | 使用催化剂可以改变E1、E2、E3的大小,从而改变正逆反应速率 | |
| C. | E2为该反应的焓变,且该反应的△H<0 | |
| D. | 该反应反应物能量大于生成物能量,故可设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Ka1 | Ka2 | |
| H2A | 1.3×10-2 | 6.3×10-6 |
| H2B | 4.2×10-7 | 5.6×10-7 |
| A. | H2A的电离方程式:H2A═2H++A2- | |
| B. | 常温下,在水中Na2B的水解平衡常数为:Ka1=$\frac{K_W}{{4.2×{{10}^{-7}}}}$ | |
| C. | 等浓度的Na2A和Na2B溶液,由水电离产生的H+浓度大小关系为:前者大于后者 | |
| D. | 向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2A=A2-+H2B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (或
(或 );
);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④⑤ | C. | ③④ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
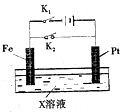 如图是一个电化学过程的示意图,请回答下列问题:
如图是一个电化学过程的示意图,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
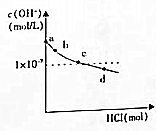
| 坐标对应点 | a | b | c | d |
| n(SO32-)n:(HSO3-) | 91:9 | 1:1 | 9:91 | |
| pH | >8.2 | 8.2 | 7.2 | 6.2 |
| A. | b点溶液中:水电离出的c(OH-)=1×10-5.8mol/L | |
| B. | c点溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) | |
| C. | d点溶液中HSO3-的电离大于水解 | |
| D. | d点溶液中:c(Na+)<c(SO32-)+c(HSO3-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com