
| A. | X/m mol | B. | 2X/3mol | C. | (X+Y)mol | D. | 2(X+Y)/3mol |
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Ka1 | Ka2 | |
| H2A | 1.3×10-2 | 6.3×10-6 |
| H2B | 4.2×10-7 | 5.6×10-7 |
| A. | H2A的电离方程式:H2A═2H++A2- | |
| B. | 常温下,在水中Na2B的水解平衡常数为:Ka1=$\frac{K_W}{{4.2×{{10}^{-7}}}}$ | |
| C. | 等浓度的Na2A和Na2B溶液,由水电离产生的H+浓度大小关系为:前者大于后者 | |
| D. | 向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2A=A2-+H2B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | Al片与少量NaOH溶液反应,产生气体:2Al+2OH-+2H2O═2Al(OH)3+3H2↑ | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-═NH3•H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (或
(或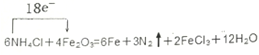 );
);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④⑤ | C. | ③④ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
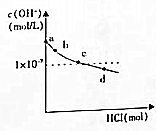
| 坐标对应点 | a | b | c | d |
| n(SO32-)n:(HSO3-) | 91:9 | 1:1 | 9:91 | |
| pH | >8.2 | 8.2 | 7.2 | 6.2 |
| A. | b点溶液中:水电离出的c(OH-)=1×10-5.8mol/L | |
| B. | c点溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) | |
| C. | d点溶液中HSO3-的电离大于水解 | |
| D. | d点溶液中:c(Na+)<c(SO32-)+c(HSO3-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2HCl+Na2CO3═2NaCl+H2O+CO2↑ | B. | 2HNO3+BaCO3═Ba(NO3)2+H2O+CO2↑ | ||
| C. | H2SO4+Na2CO3═Na2SO4+H2O+CO2↑ | D. | H2SO4+(NH4)2CO3═(NH4)2SO4+H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com