
【题目】下列叙述中正确的是( )
A.凡是盐在离子方程式中都要以离子的形式来表示
B.离子反应一定使溶液中所有离子的浓度都发生变化
C.复分解反应必须具备离子反应的某个条件
D.酸碱中和反应都能用离子方程式:H++OH-=H2O表示
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:
【题目】X、Y、W、Q 四种元素在元素周期表中的位置如图,下列叙述错误的是

A. Y 的氢化物沸点高于 Q 的氢化物沸点
B. 最高正价与最低负价之和为 0 的元素只有 W
C. 原子半径顺序为:r(W)>r(Q)>r(Y)>r(X)
D. Q的水溶液具有漂白性,能使有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用四氯化碳萃取碘的饱和水溶液中的碘,下列说法不正确的是
A.实验使用的仪器是分液漏斗
B.碘在四氯化碳中的溶解度比在水中的溶解度大
C.碘的四氯化碳溶液呈紫红色
D.分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌、氮化镓及新型多相催化剂组成的纳米材料能利用可见光分解水,生成氢气和氧气。
Zn2+基态核外电子排布式为______________,其核外存在______________对自旋相反的电子。
写出两个与水分子具有相同空间构型的分子和阴离子:__________,____________。
水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是______________(填序号)。
A、氧原子的杂化类型发生了改变 B、微粒的空间构型发生了改变
C、微粒的化学性质发生了改变 D、微粒中的键角发生了改变
在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图甲),已知冰的升华热是+51kJ![]() mol-1,除氢键外,水分子间还存在范德华力(11kJ
mol-1,除氢键外,水分子间还存在范德华力(11kJ![]() mol-1),则冰晶体中氢键的键能是___________kJ
mol-1),则冰晶体中氢键的键能是___________kJ![]() mol-1。
mol-1。
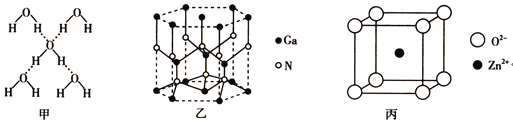
氮化镓的晶体结构如图乙所示,其中氮原子的杂化轨道类型是______________;N、Ga原子之间存在配位键,该配位键中提供电子对的原子是______________;该晶体的化学式为______________。金刚砂(SiC)和氮化镓并称为第三代半导体材料的双雄,它与金刚石具有相似的晶体结构,试比较金刚石和金刚砂的熔点高低,并说明理由:__________________________。
某种ZnO晶体的晶胞如图丙所示,Zn2+的配位数为_______________,其晶胞中Zn2+和O2-之间的距离为apm,列式表示该晶体的密度:____________g![]() cm-3(不必计算结果)。
cm-3(不必计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年诺贝尔化学奖授予三位美国科学家,以表彰他们如光合作用叶绿体光反应时酶中、生物固氮时固氮酶中)的化学反应。
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯,下列说法正确的有________(不定项选择)。
a.C2H2、C2H4都是非极性分子
b.碳负离子CH![]() 呈三角锥形
呈三角锥形
c.NO+电子式为[∶NO∶]+
d.NH3沸点比N2高,主要是因为前者是极性分子
(2)钒可合成电池电极,也可人工合成二价钒(V)固氮酶(结构如图)
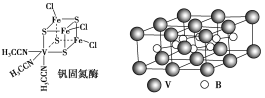
①V2+基态时核外电子排布式为______________________________________。
②钒固氮酶中钒的配位原子有________(写元素符号)。
③熔融空气电池钒硼晶体晶胞结构如图所示,该晶胞中含有钒原子数目为________。
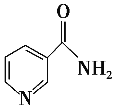
(3)烟酰胺(结构简式如图)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有________,1 mol该分子中含σ键的数目为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中的编号代表所对应的元素。请回答下列问题: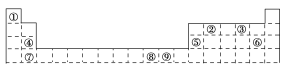
(1)⑨号元素的基态原子的价电子排布式是________,与其同周期,且基态原子的核外未成对电子数最多的元素是______________________(写出元素符号),②号元素基态原子的电子排布图为________。
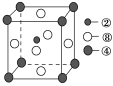
(2)①号与③号元素形成的含有18电子的物质为________(写出名称),②号与③号元素形成的,能造成温室效应的物质的立体构型为________。②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为________(用对应的元素符号表示),常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是_______________________________。
(3)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,有关该分子的说法中正确的是________。
a.该分子属于含有极性键的非极性分子
b.该分子含有4个σ键和1个π键
c.该分子中的②号原子采取sp2杂化
d.该物质易溶于水,并能和水反应得到酒精
(4)某元素的价电子排布式为nsnnpn+1,该元素可与元素①形成含有10个电子的分子X,将过量的X通入盛有硫酸铜溶液的试管里,产生的现象为_________________________。
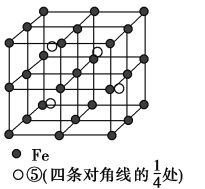
(5)若元素⑤与Fe元素形成的某种晶体如图所示。若晶胞的边长为a nm,则合金的密度为________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度T℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下[2NO2(g)![]() N2O4(g) △H<0]:
N2O4(g) △H<0]:
容器 | 物质 | 起始浓度/(mol | 平衡浓度/(mol |
Ⅰ | N2O4 | 0.100 | 0.040 |
NO2 | 0 | 0.120 | |
Ⅱ | N2O4 | 0 | 0.0142 |
NO2 | 0.100 | 0.0716 |
下列说法不正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应的转化率a(N2O4)>a(NO2)
B. 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ)
C. 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(I)=![]()
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com